
RNA 甲基化指發(fā)生在RNA 分子上不同位置的甲基化修飾現(xiàn)象,常見的RNA轉錄后修飾方式有6-甲基腺嘌呤(N6-methyladenosine,m6A) 和5-甲基胞嘧啶(C5-methylcytidine,m5C)。
研究發(fā)現(xiàn),m6A修飾在調(diào)控基因表達、剪接、RNA 編輯、RNA 穩(wěn)定性、控制mRNA壽命和降解、介導環(huán)狀RNA翻譯等方面扮演重要角色。因此MeRIP-seq助力解決細胞分化、生物發(fā)育、疾病發(fā)生發(fā)展、熱休克反應等生物學問題。
利用甲基化RNA免疫共沉淀結合高通量測序 (Methylated RNA Immunoprecipitation sequening,MeRIP-seq)技術,可以對RNA轉錄后甲基化修飾圖譜進行研究,是表觀轉錄組學研究的關鍵技術。
表觀遺傳學,包括組蛋白共價修飾(covalenthistone modification)、DNA 甲基化修飾(DNAmethylation)、RNA 甲基化修飾(RNA methylation)、基因組印記(genomic imprinting)、基因沉默(genesilencing)、RNA 編輯(RNA editing)及非編碼RNA(noncoding RNA)等,是指在核苷酸序列不發(fā)生改變的情況下,生物表型或基因表達發(fā)生了穩(wěn)定的可遺傳變化。RNA 甲基化作為表觀遺傳學研究的重要內(nèi)容之一,是指發(fā)生在RNA 分子上不同位置的甲基化修飾現(xiàn)象, 6- 甲基腺嘌呤(N6-methyladenosine, m6A)是真核生物中常見的RNA 轉錄后修飾。RNA 甲基化在調(diào)控基因表達、剪接、RNA 編輯、RNA 穩(wěn)定性、控制mRNA壽命和降解等方面可能扮演重要角色。 相對于DNA 甲基化,RNA 甲基化更加復雜、種類繁多、普遍存在于各種高等生物中。
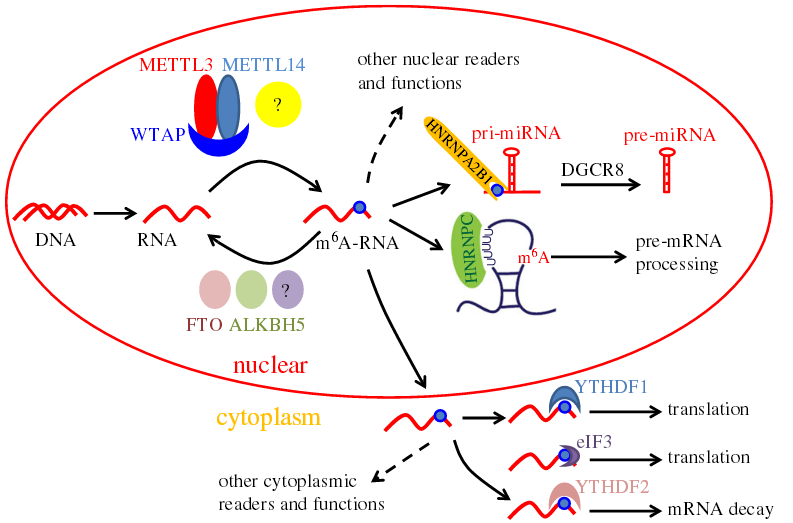
m6A修飾的機制與功能
m6A 甲基化修飾是由一個多蛋白復合物介導產(chǎn)生,目前已知這個復合物的成分包括METTL3,METTL14 和 WTAP;去甲基化酶 FTO 和 ALKBH5則負責擦除甲基化修飾基團。在細胞核中的 HNRNPC 負責識別m6A修飾基團,并介導mRNA前體的選擇性剪接。而另外一個m6A識別蛋白 HNRNPA2B1則促進 pri-miRNA 加工成 pre-miRNA。在細胞質(zhì)中,不同的 m6A 位點識別蛋白介導不同的功能。YTHDF1 和YTHDF3識別 m6A 修飾 mRNA,通過與起始因子及核糖體相互作用促進蛋白質(zhì)翻譯,eIF3識別蛋白也會直接綁定到 mRNA 5’UTR 端的 m6A位點參與翻譯起始。而另外一個識別蛋白 YTHDF2 與 m6A 的結合將導致 mRNA 的降解。
MeRIP-seq 測序文庫制備過程如下:首先從樣本細胞組織中分離出RNA,考慮到總RNA 中含有大量的rRNA 序列,因此需要結合不同的方法去除其中的rRNA。對于真核生物而言,常采用Poly(T)寡核苷酸提取出帶Poly(A)的RNA 去除rRNA;而對不含Poly(A)尾的轉錄本序列以及存在部分降解的總RNA 樣本而言,需要試劑盒去除rRNA,從而得到除rRNA 外的全部RNA,然后將提取出的RNA 隨機打斷。MeRIP-seq 技術對帶有甲基化修飾的片段(IP 樣本)進行測序時,需要平行對一個對照樣本(Control 樣本)進行測序, 其IP 樣本和Control 樣本的片段選擇方法主要有以下2 種:a.將打斷的RNA 片段分成兩份,一份直接用于制備Control 樣本的cDNA 文庫,另一份采用抗m6A抗體與被打斷的RNA 進行孵育,抓取帶有m6A 修飾的片段,用于制備IP 樣本的cDNA 文庫.由于測序得到的結果不以所有RNA 片段為背景,稱這樣得到的IP 樣本和Control 樣本是非成對的(unpair),在進行數(shù)據(jù)處理時需先對Control 樣本進行處理。b.取兩份相同的RNA 進行打斷,其中一份所有的RNA 片段都進行測序,作為Control樣本,另一份采用抗m6A 抗體抓取帶有m6A 修飾的片段進行測序作為IP 樣本。由于測序得到的IP樣本背景為當前測序得到的Control 樣本,稱這樣得到的IP 樣本和Control 樣本是成對的(pair),可直接用于數(shù)據(jù)處理。獲取測序片段后(包括IP 樣本測序片段和Control 樣本測序片段),用隨機引物和反轉錄酶從RNA 片段合成雙鏈cDNA。然后,對合成的cDNA進行末端修復并在3′端加“A”,使用特定測序接頭(adapter)連接cDNA 片段兩端,從而得到用于測序的cDNA。通常情況下,為了得到更高的測序效率,一般采用電泳切膠法獲取一定長度的cDNA,再對其進行PCR 擴增,得到所需的cDNA 文庫。
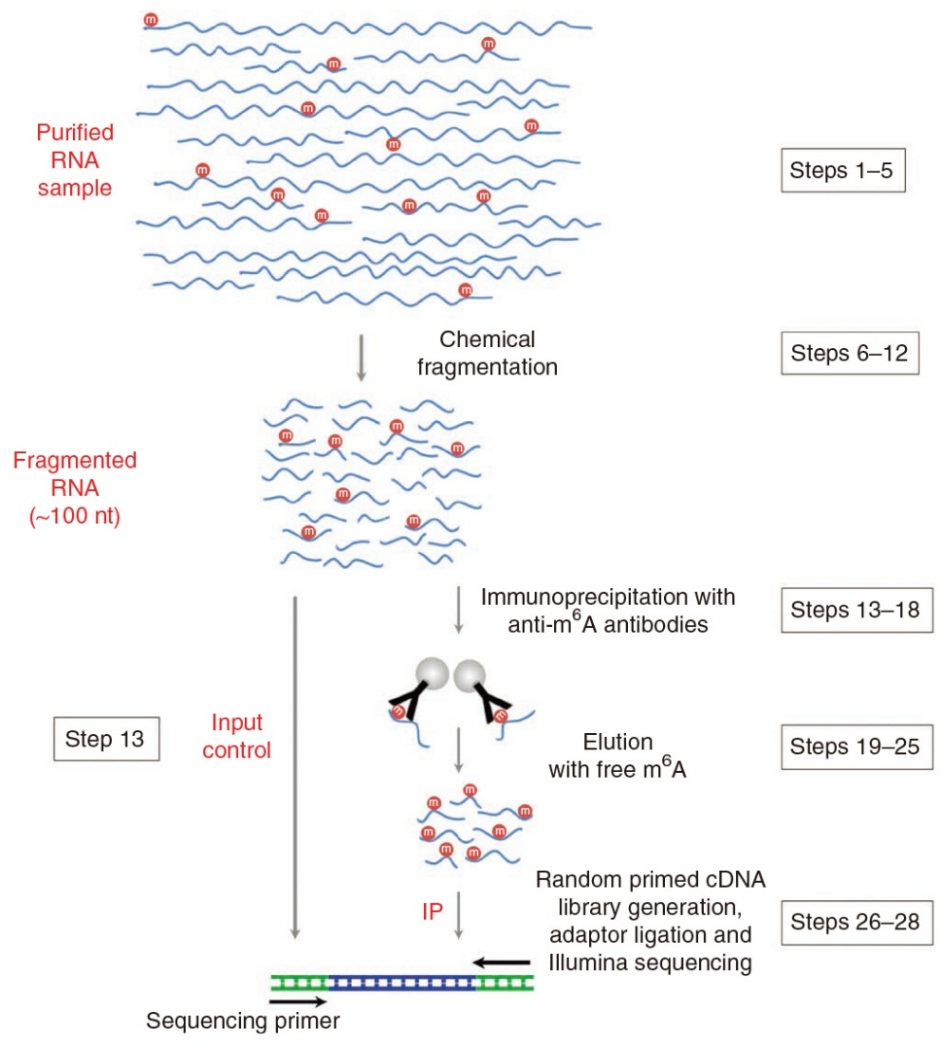
實驗組VS對照組,建議3-5:3-5
組內(nèi)對照:IP組VS in put組(input組主要用于比較鑒定IP組的抗體特異性結合,是常備的組分)
測序模式:PE150
數(shù)據(jù)量:20M clean reads
項目周期:50天

