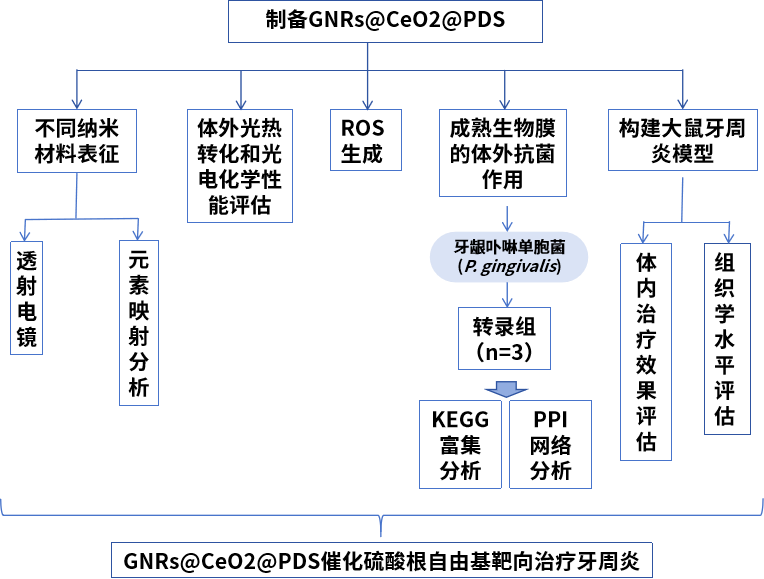
文章題目:Gold core@CeO2 halfshell Janus nanocomposites catalyze targeted sulfate radical for periodontitis therapy
吉林大學(xué)在《Journal of Controlled Release》上發(fā)表了金核@CeO2半殼Janus納米復(fù)合材料催化硫酸根自由基靶向治療牙周炎的研究成果��。本研究中轉(zhuǎn)錄組檢測(cè)及部分?jǐn)?shù)據(jù)分析工作由上海派森諾生物科技股份有限公司完成�����。
牙周病是第六大最常見(jiàn)的慢性感染性炎癥疾病,與許多慢性非傳染性疾病密切相關(guān)����,引起了相當(dāng)大的關(guān)注�����。由于牙周結(jié)構(gòu)獨(dú)特的解剖復(fù)雜性,包括深牙周袋和牙根解剖結(jié)構(gòu)的特異性�����,加上抗生素耐藥性日益嚴(yán)峻的挑戰(zhàn)�����,顯著限制了其治療效果�。近年來(lái)����,光催化抗菌治療(PCAT)在治療微生物感染的前瞻性方法中占有突出地位。通過(guò)利用光催化產(chǎn)生的活性氧(ROS)的能量��,有效地湮滅了微生物�����。其中��,硫酸鹽自由基(SO4?-)以其高反應(yīng)活性和長(zhǎng)壽命而聞名,已成為一種有效的抗菌劑���。然而,盡管它有潛力�,高效地生成這種自由基仍然是一個(gè)巨大的挑戰(zhàn)���,特別是通過(guò)涉及納米酶和光催化的方法����。
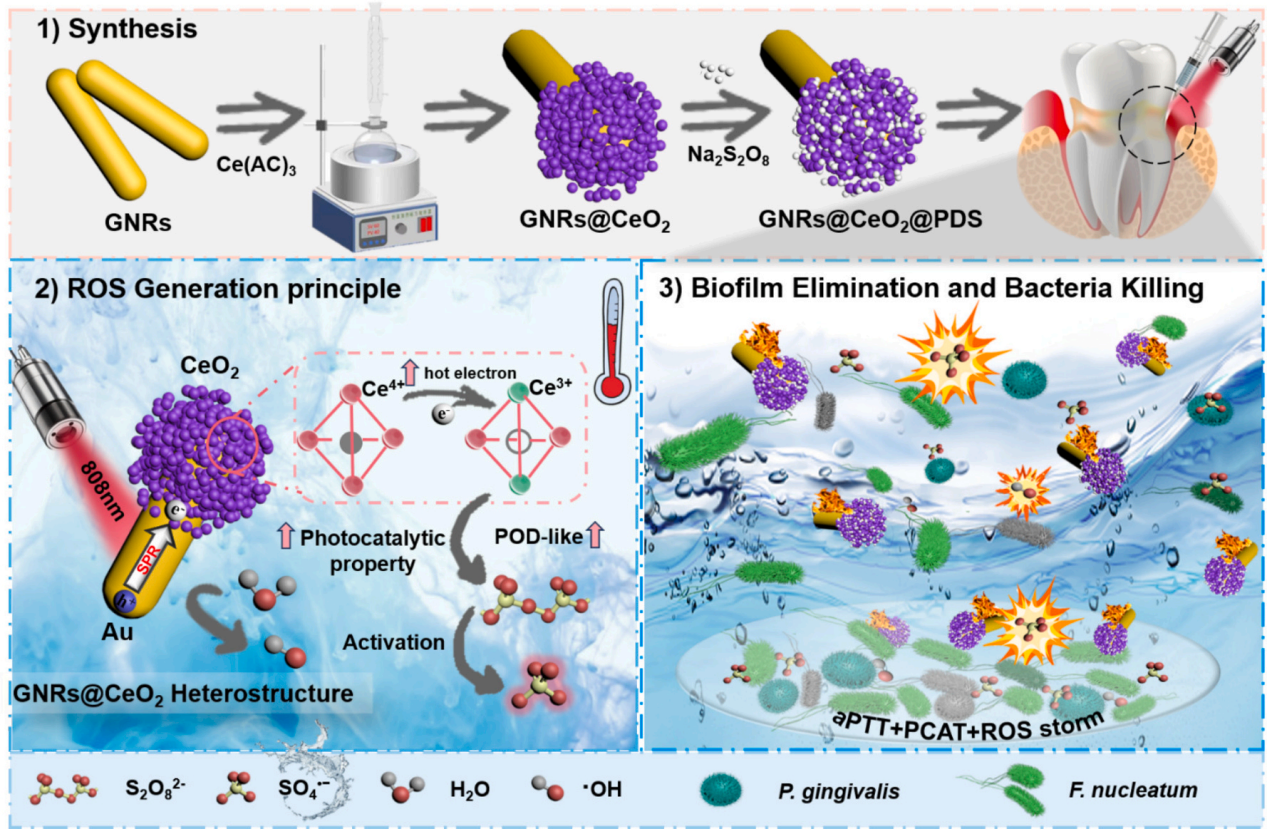
利用氧化鈰(CeO2)納米酶的過(guò)氧化物酶(POD)模擬活性和光催化特性,與等離子體金納米棒(GNR)的增強(qiáng)概念相結(jié)合,開(kāi)發(fā)了一種負(fù)載過(guò)硫酸鹽的半封裝核殼GNRs@CeO2 Janus異質(zhì)結(jié)構(gòu)(圖1)�����。
圖1 h-GNRs@CeO2@PDS NCs的設(shè)計(jì)示意圖
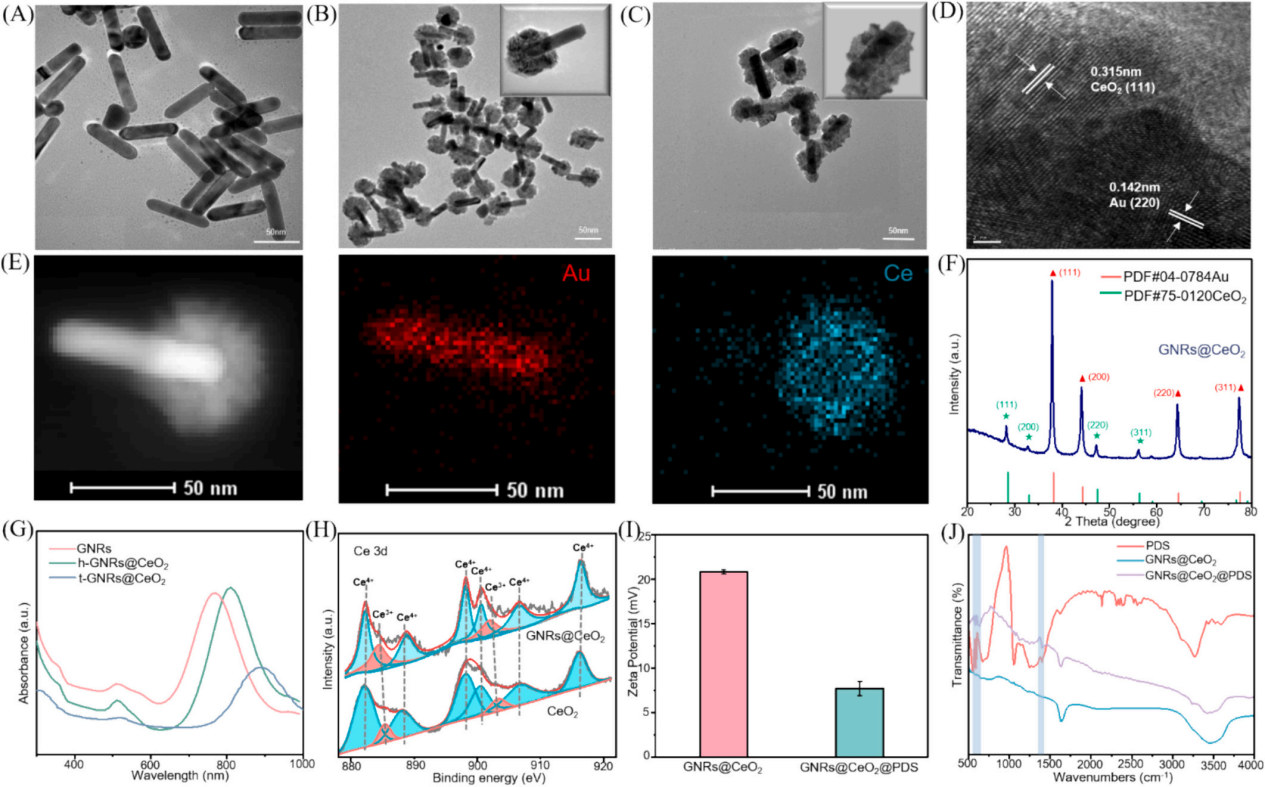
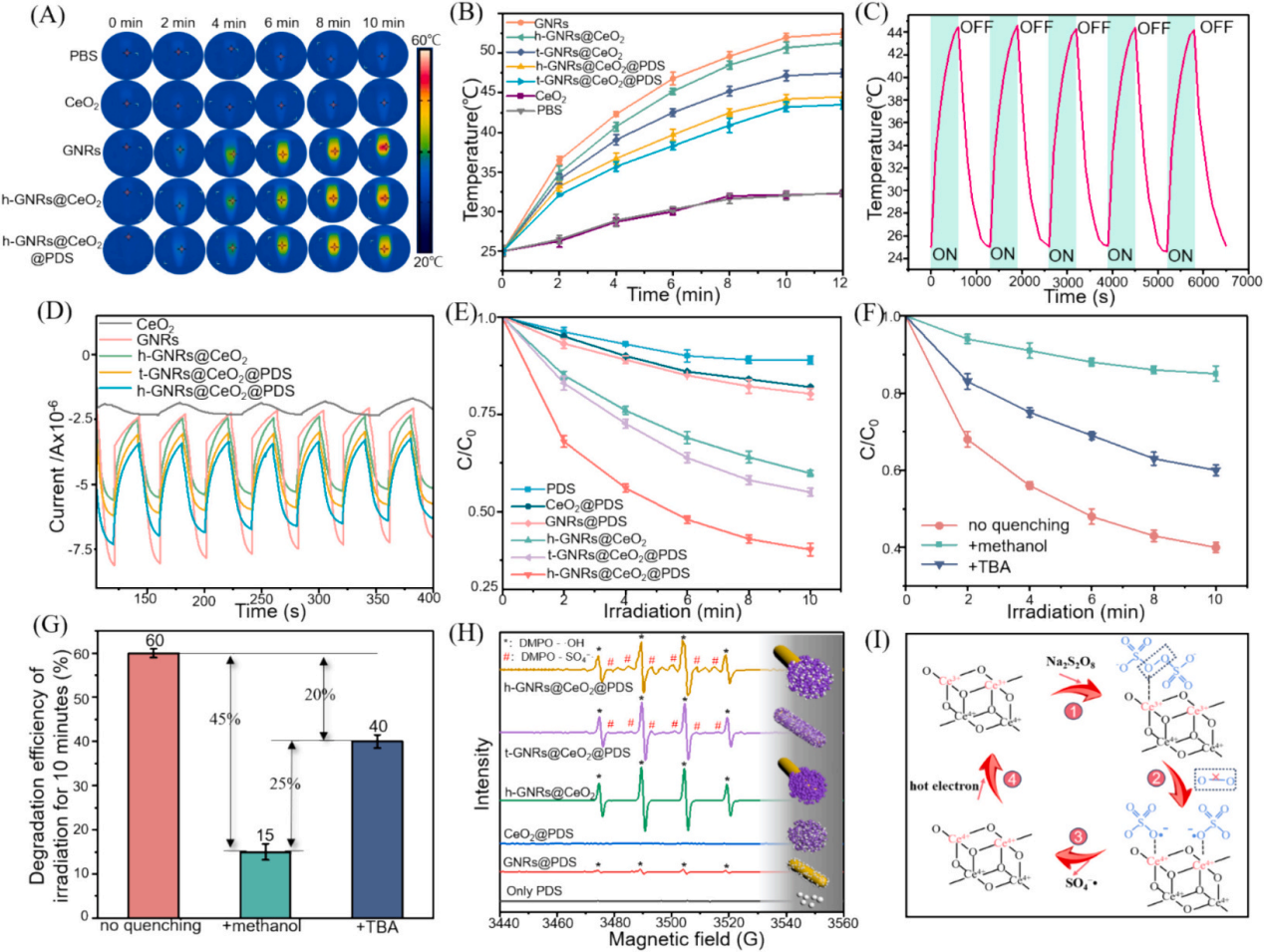
圖2A�、B、C顯示了GNR的透射電子顯微鏡(TEM)圖像,h-GNRs@CeO2和t-GNRs@CeO2分別地GNR呈現(xiàn)出長(zhǎng)度為50-100 nm的均勻棒狀。CeO2在GNR上實(shí)現(xiàn)定向單端外延生長(zhǎng)���,形成蘑菇狀結(jié)構(gòu)h-GNRs@CeO2全方位封裝成型t-GNRs@CeO2分別地CeO2在兩者上均表現(xiàn)出多孔殼結(jié)構(gòu)����,這有利于PDS的有效負(fù)載���。樣品在水溶液中表現(xiàn)出良好的分散性����,無(wú)聚集跡象����。HRTEM圖像顯示了其獨(dú)特的平面結(jié)晶特征(圖2D)。元素映射分析表征了Ce和Au在納米結(jié)構(gòu)中的元素分布。結(jié)果清楚地表明,只有一端被CeO2殼層覆蓋��。X射線粉末衍射(XRD)結(jié)果表明�����,CeO2殼層和GNRs具有晶體結(jié)構(gòu)(圖2E-F)���。GNRs@CeO2的XRD譜圖與CeO2和Au的譜圖吻合較好(圖2G)�。圖2H表示CeO2和GNRs@CeO2的x射線光電子能譜(XPS)���,用于檢測(cè)表面元素及其價(jià)態(tài)���。
如圖2I所示���,確定GNRs@CeO2的電勢(shì)為+20 mV��。同時(shí)���,PDS里的S2O82?具有很強(qiáng)的負(fù)電荷特性�����,通過(guò)靜電吸引很容易加載到GNRs@CeO2的正電荷表面,使GNRs@CeO2表面的正電荷減少,表明PDS加載成功��。此外��,GNRs@CeO2@PDS以其陽(yáng)離子表面為特征����,主要通過(guò)與帶負(fù)電的細(xì)菌膜的靜電相互作用表現(xiàn)出顯著的抗菌活性��。這種相互作用強(qiáng)調(diào)了它們作為有效抗菌材料的潛力���。此外�,我們進(jìn)一步進(jìn)行了傅立葉變換紅外光譜(FTIR)分析�����,以驗(yàn)證PDS封裝的有效性�����。
GNRs@CeO2@PDS的體外光熱轉(zhuǎn)化和光電化學(xué)性能
圖3A和B描繪了光熱圖像和相應(yīng)的溫度測(cè)量結(jié)果��,表明溫度隨著照射時(shí)間的推移而升高�����,這一現(xiàn)象在純GNR中最為明顯。此外����,PDS和熱電子的存在增強(qiáng)了電子傳遞效率���,促進(jìn)了鈰的價(jià)態(tài)轉(zhuǎn)變����,催化活性提高��。如圖3C所示����,在相同條件下�����,h-GNRs@CeO2@PDS的光熱性能在連續(xù)五個(gè)照射周期中保持一致�,表明具有強(qiáng)大的光熱穩(wěn)定性��。光致電流-時(shí)間(i-t)曲線(圖D)清楚地表明�,與單獨(dú)使用CeO2相比�����,引入GNR會(huì)導(dǎo)致電流顯著上升。
在808 nm近紅外照射下,PDS無(wú)法產(chǎn)生可觀的SO4?-,CeO2@PDS和GNRs@PDS組表現(xiàn)出有限的降解能力�。而h- GNRs@CeO2@PDS組件表現(xiàn)出顯著增強(qiáng)的降解性能可能是由于GNR激發(fā)的熱電子轉(zhuǎn)移到CeO2上��,促使Ce4+廣泛轉(zhuǎn)化為Ce3+,這有效地激活了PDS,從而產(chǎn)生了大量的SO4?-。同時(shí),水分子被SO4?-氧化生成額外的?OH。因此,該體系中存在大量的?OH和SO4?-���,形成了“自由基風(fēng)暴”。如圖F和G所示,添加TBA后10 min, MB的降解率從60%下降到40%,而甲醇的存在導(dǎo)致MB的降解效率僅為15%�,說(shuō)明h-GNRs@CeO2@PDS可以同時(shí)生成SO4?-和?OH�����。
隨后�����,采用電子順磁共振(EPR)分析來(lái)檢測(cè)直接來(lái)自不同納米材料的活性SO4?-和?OH自由基的特征,結(jié)果表明h-GNRs@CeO2可以激活PDS并促進(jìn)活性自由基以及?OH和SO4?-自由基的形成(圖3H)����。與完全封裝的GNR相比��,半封裝態(tài)表現(xiàn)出更好的光吸收能力,從而能夠更有效地將電子轉(zhuǎn)導(dǎo)到CeO2�����,并在PDS的活化中表現(xiàn)出更強(qiáng)的催化和酶促功效���。
圖3 各種納米材料的光熱轉(zhuǎn)換����、光電化學(xué)性能和活性氧生產(chǎn)能力
GNRs@CeO2@PDS NCs對(duì)成熟生物膜的體外抗菌作用
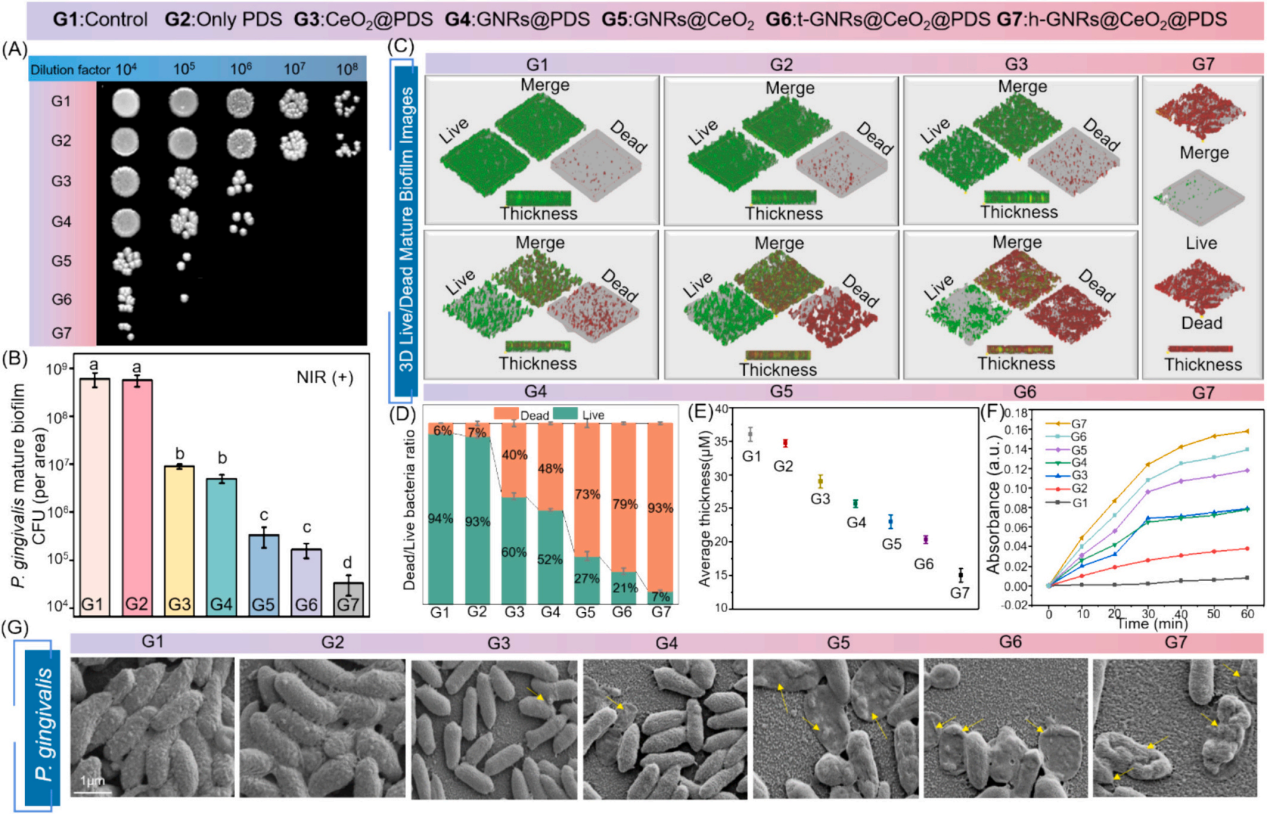
為了測(cè)試納米材料光催化性能的治療效果,進(jìn)一步評(píng)估了GNRs@CeO2@PDS對(duì)口腔致病性厭氧菌的影響。圖4A和B繪制了不同納米材料在808 nm近紅外照射下處理的成熟牙齦卟啉單胞菌(P. gingivalis)生物膜的菌落形成單位(CFU)計(jì)數(shù)。h-GNRs@CeO2@PDS + NIR在所有測(cè)試組中表現(xiàn)出最高的抗生素膜效率。
此外��,我們通過(guò)活/死染色構(gòu)建了3D圖像���,以直觀地評(píng)估不同材料處理后成熟生物膜厚度的變化和深層細(xì)菌的生存狀態(tài)��。從圖4C-4E可以看出,CeO2@PDS、GNRs@PDS和GNRs@CeO2基團(tuán)的抗生物膜作用是不可忽視的�����,它取決于CeO2本身的抗菌性能����、光熱效應(yīng)和?OH氧化。在此基礎(chǔ)上,我們利用掃描電鏡(SEM)對(duì)不同納米材料在808 nm近紅外照射下的抗菌膜效果進(jìn)行了定性評(píng)價(jià)�����。如圖4G所示�,與對(duì)照組和其他實(shí)驗(yàn)組相比,受益于aPTT和ROS風(fēng)暴聯(lián)合處理的h- GNRs@CeO2@PDS + NIR組的生物膜面積減少最為顯著,t-GNRs@CeO2@PDS + NIR組和GNRs@CeO2 + NIR組緊隨其后。細(xì)胞膜的破壞導(dǎo)致細(xì)胞內(nèi)成分(如DNA和RNA)釋放到周圍環(huán)境中�����,最終導(dǎo)致細(xì)菌死亡���。如圖F所示��,h- GNRs@CeO2@PDS組與其他組相比����,OD260值升高��,表明核酸泄漏更廣泛����,抗菌活性更高����。因此��,h-GNRs@CeO2@PDS被808 nm近紅外激光激活后���,顯示出顯著的抗菌活性����,有效地破壞了生物膜���,從而為根除牙周菌斑生物膜進(jìn)而有效根除病原體。
圖4 近紅外輻照下不同納米材料對(duì)牙齦假單胞菌生物膜的抵抗能力
GNRs@CeO2@PDS NC治療后牙齦卟啉單胞菌的轉(zhuǎn)錄組學(xué)分析
為了深入研究基于硫酸鹽自由基的抗菌機(jī)制��,選擇牙齦卟啉單胞菌作為模型生物��,并對(duì)對(duì)照組和GNRs@CeO2@PDS組進(jìn)行了轉(zhuǎn)錄組學(xué)分析���。暴露于GNRs@CeO2@PDS后�����,共發(fā)現(xiàn)608個(gè)顯著差異表達(dá)基因,其中343個(gè)下調(diào)基因�,265個(gè)上調(diào)基因(圖5A-B)��。KEGG通路分析發(fā)現(xiàn)相關(guān)的途徑包括雙組分系統(tǒng)(TCS)、核糖體生物發(fā)生��、三羧酸(TCA)循環(huán)和丁酸生物合成��,每種途徑都有助于生物體對(duì)處理誘導(dǎo)的強(qiáng)大ROS環(huán)境的反應(yīng)(圖5C)����。研究證實(shí)牙齦卟啉單胞菌在牙周感染中的毒力很大程度上依賴于菌毛的表達(dá)�����。圖D-5F所示的相互作用熱圖和蛋白-蛋白相互作用(PPI)網(wǎng)絡(luò)揭示了TCS內(nèi)關(guān)鍵基因的下調(diào),表明長(zhǎng)毛和短毛均受到抑制�。這種抑制限制了牙齦卟啉單胞菌形成生物膜的能力及其傳染性�,損害了其檢測(cè)和調(diào)節(jié)環(huán)境變化的能力����。此外,在核糖體途徑中�,我們的研究發(fā)現(xiàn)了與30S和50S亞基相關(guān)的一組基因的下調(diào)(圖5E-5G)�����,這種核糖體損傷會(huì)導(dǎo)致細(xì)菌死亡。
此外��,當(dāng)細(xì)菌重要的內(nèi)部和外部結(jié)構(gòu)被破壞時(shí)����,支持重要生命過(guò)程的能量供應(yīng)的重要代謝途徑TCA循環(huán)也被抑制了。作為專性厭氧菌�����,牙齦卟啉單胞菌主要依靠TCA循環(huán)維持和增殖�����。在使用GNRs@CeO2@PDS處理后���,與該循環(huán)相關(guān)的基因顯著下調(diào)(圖5E和5H)����,表明強(qiáng)健的ROS環(huán)境限制了細(xì)菌的能量供應(yīng)����,嚴(yán)重?fù)p害了細(xì)菌的生存能力���。此外���,我們的分析表明����,TCA循環(huán)中丙酮酸轉(zhuǎn)化為乙酰輔酶a的代謝途徑與細(xì)菌丁酸生物合成途徑部分相交,兩者之間存在潛在的相互作用動(dòng)力學(xué),如圖5J所示��。
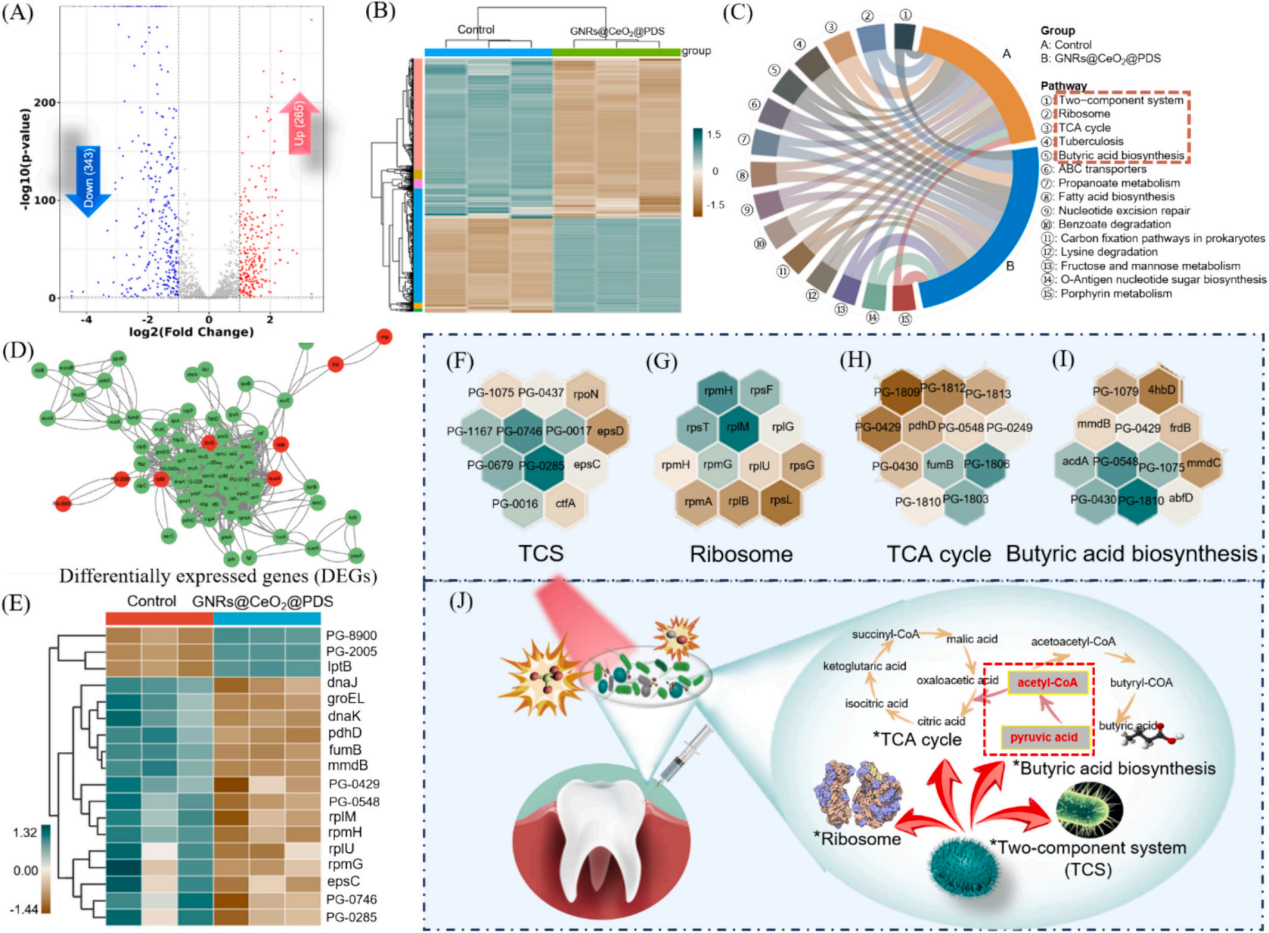
圖5 使用RNA-seq對(duì)GNRs@CeO2@PDS治療后牙齦卟啉單胞菌生物膜的整體評(píng)估
GNRs@CeO2@PDS對(duì)牙周感染的體內(nèi)治療效果
最后��,我們研究了利用GNRs@CeO2@PDS在感染牙周病原體的動(dòng)物模型中通過(guò)PCAT在體內(nèi)治療牙周炎的可行性�。大鼠牙周炎模型的詳細(xì)治療步驟如圖6a所示�。感染后7天,將不同的納米材料放入牙周袋�����,在治療第一天進(jìn)行808 nm近紅外成像,通過(guò)紅外成像監(jiān)測(cè)溫度變化(圖6B-C)。GNRs@CeO2@PDS組在10分鐘內(nèi)達(dá)到43.7 ℃的溫度�����,這種最佳光熱反應(yīng)有利于體內(nèi)生物膜的消耗����,
經(jīng)過(guò)14天的治療方案,在幾個(gè)組(空白對(duì)照組�����,炎癥對(duì)照組���,PDS, GNRs@PDS, CeO2@PDS, GNRs@CeO2, GNRs@CeO2@PDS)中����,顯微計(jì)算機(jī)斷層掃描(Micro-CT)提供了上頜磨牙的3D重建(圖6D)����。通過(guò)測(cè)量牙骨質(zhì)連接(CEJ)和牙槽骨嵴(ABC)之間的距離來(lái)量化牙槽骨吸收,結(jié)果如圖6E所示���。GNRs@CeO2@PDS組(0.46±0.05 mm)由于光熱效應(yīng)對(duì)牙周生物膜的耗散以及?OH和SO4?-對(duì)牙周病原體的共同作用,牙槽骨的修復(fù)效果最為顯著�,從而顯著降低了致病性�����,有效地治療了牙周炎。
為了直觀地評(píng)估治療效果�����,拍攝了大鼠模型的口腔照片����。GNRs@CeO2@PDS NCs處理的牙齦組織呈現(xiàn)健康外觀,而陽(yáng)性對(duì)照則表現(xiàn)出明顯的紅腫(圖6F)。此外�����,為了驗(yàn)證活性氧�����,特別是SO4?-在牙周環(huán)境中的功能存在�����,我們進(jìn)行了體內(nèi)熒光分析��。如圖G所示���,利用探針2 '��,7 ' -二氯二氫熒光素二乙酸酯(DCFH-DA)來(lái)測(cè)量?OH和SO4?-的集體活性。添加SO4?-特異性探針NAP進(jìn)一步增強(qiáng)了熒光�,證實(shí)了我們之前的觀察結(jié)果(圖6H)���。這些結(jié)果表明�����,aPTT和ROS風(fēng)暴的協(xié)同作用不僅減少了牙周組織中的細(xì)菌菌落,而且顯著緩解了相關(guān)的炎癥狀態(tài)����。
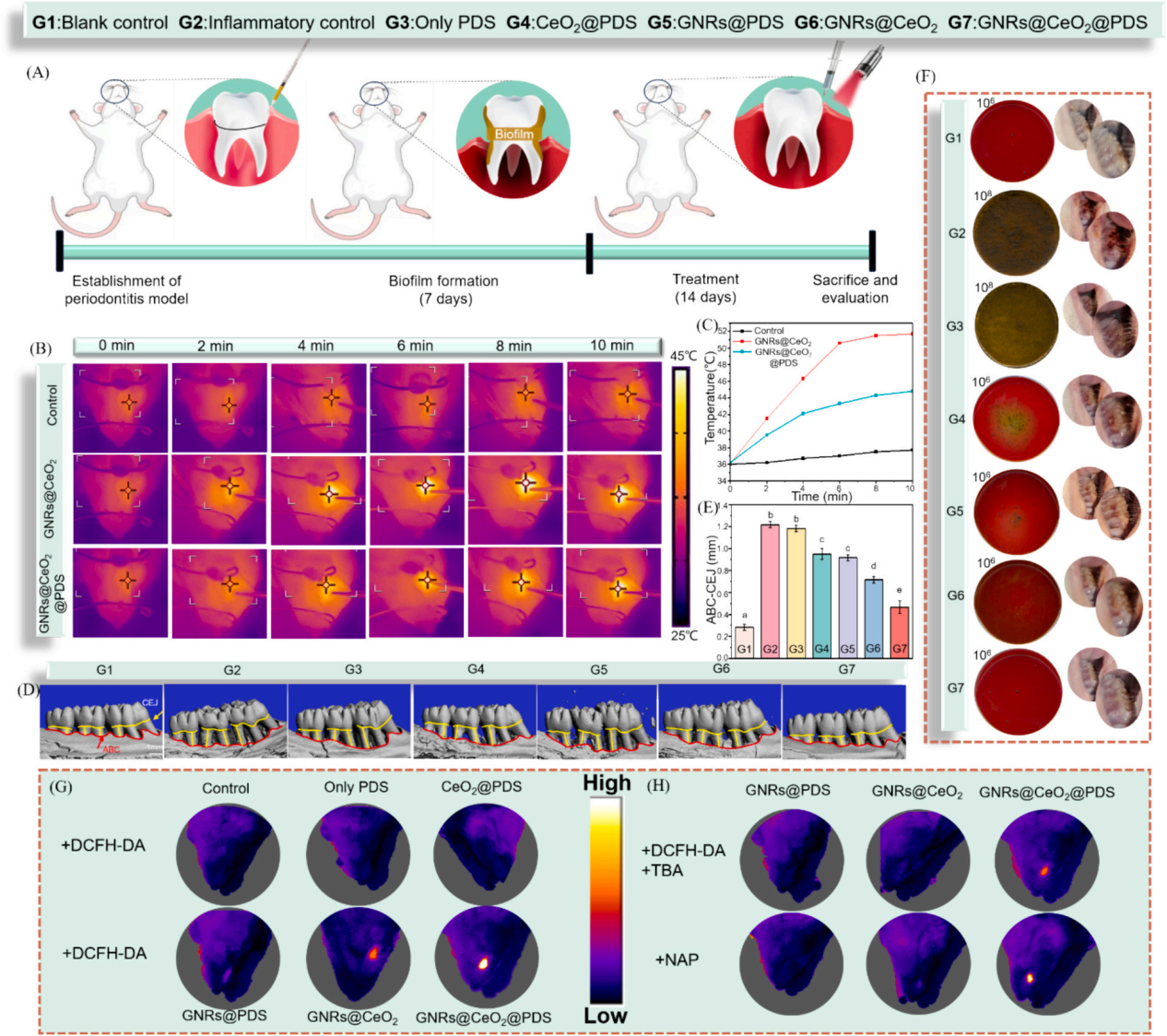
圖6 體內(nèi)評(píng)價(jià)不同納米材料治療牙周炎的效果
本研究利用氧化鈰(CeO2)納米酶的過(guò)氧化物酶(POD)模擬活性和光催化特性�,與等離子體金納米棒(GNR)的增強(qiáng)概念相結(jié)合,開(kāi)發(fā)了一種負(fù)載過(guò)硫酸鹽的半封裝核殼GNRs@CeO2 Janus異質(zhì)結(jié)構(gòu)�。在近紅外光照射下����,GNR產(chǎn)生熱電子,從而提高CeO2的類酶活性��,并引發(fā)一個(gè)由 ?OH和SO4?- 組成的強(qiáng)大ROS風(fēng)暴���。這種獨(dú)特的納米結(jié)構(gòu)促進(jìn)了功能專門化��,其中異質(zhì)結(jié)構(gòu)和高效的光吸收確保了連續(xù)的熱電子流�,不僅增強(qiáng)了CeO2有效生產(chǎn)SO4?-的類酶活性�,還貢獻(xiàn)了顯著的光熱效應(yīng)���,破壞牙周菌斑生物膜進(jìn)而有效根除病原體���。此外�,局部溫度的升高協(xié)同增強(qiáng)了CeO2的POD酶活性。另外��,轉(zhuǎn)錄組學(xué)分析以及動(dòng)物牙周炎模型的實(shí)驗(yàn)表明���,病原體在強(qiáng)大的ROS系統(tǒng)中經(jīng)歷遺傳信息破壞�����、代謝紊亂和致病性變化�,并在動(dòng)物牙周表現(xiàn)出顯著的抗炎和骨保存的治療結(jié)果�。本研究表明,能量轉(zhuǎn)移以增強(qiáng)納米酶的活性�,特別是針對(duì)高效ROS的產(chǎn)生��,成為了抗菌治療的一個(gè)重要進(jìn)展。隨著進(jìn)一步研究和試驗(yàn)的開(kāi)展���,這一新技術(shù)有望在未來(lái)改變牙周病的治療景觀。
原文索引:
Li S, Ding Q, Zhang L, Shi F, Liu C, Li T, Shi Y, Qi M, Wang L, Dong B, Song S, Sun J, Kim JS, Li C. Gold core@CeO2 halfshell Janus nanocomposites catalyze targeted sulfate radical for periodontitis therapy. J Control Release. 2024 May 14;370:600-613. doi: 10.1016/j.jconrel.2024.05.016. Epub ahead of print. PMID: 38735394.