
2023-12-15

《ACS Nano》
影響因子:17.1
哈爾濱工業大學顧寧教授團隊在《ACS Nano》發表題為“Foodborne Carbon Dot Exposure Induces Insulin Resistance through Gut Microbiota Dysbiosis and Damaged Intestinal Mucus Layer”的文章。闡釋了慢性碳點(CD)暴露可通過破壞小鼠的腸-肝軸導致葡萄糖代謝紊亂。該研究通過高通量測序分析揭示了,CD暴露降低了有益細菌(Bacteroides、Coprococcus和S24-7)的豐度,增加了有害細菌(Proteobacteria、Oscillospira、Desulfovibrionaceae和Ruminococcaceae)的豐度以及F/B(Firmicutes/Bacteroidetes)比率。通過對比無腸道菌群小鼠和有腸道菌群小鼠可發現,暴露于CD小鼠出現胰島素抗性的原因在于腸道菌群紊亂和腸道粘液層的破壞。
以上研究的16S rRNA基因測序和部分數據分析工作由上海派森諾生物科技股份有限公司完成。
研究背景
碳點(CD)是一種新興的碳基納米材料,其直徑通常<10 nm,在許多應用中都展現出了優異的性質。自從發現CD以來,研究主要集中在CD的制備和應用上,而忽略了其潛在的醫療風險。由于食物成分在高溫下容易碳化,烹飪過程中會產生食源性CD;在飲料、烘焙食品和烤肉中這一現象尤為普遍。體內和體外研究表明,CD會導致某些不良影響,如細胞活力降低、細胞凋亡、細胞周期中斷和代謝應激。盡管如此,暴露于慢性食源性CD與葡萄糖代謝之間的關系仍不清楚。
測序區域
16S rRNA基因 V3V4區
測序平臺&分析
Illumina NovaSeq+派森諾基因云
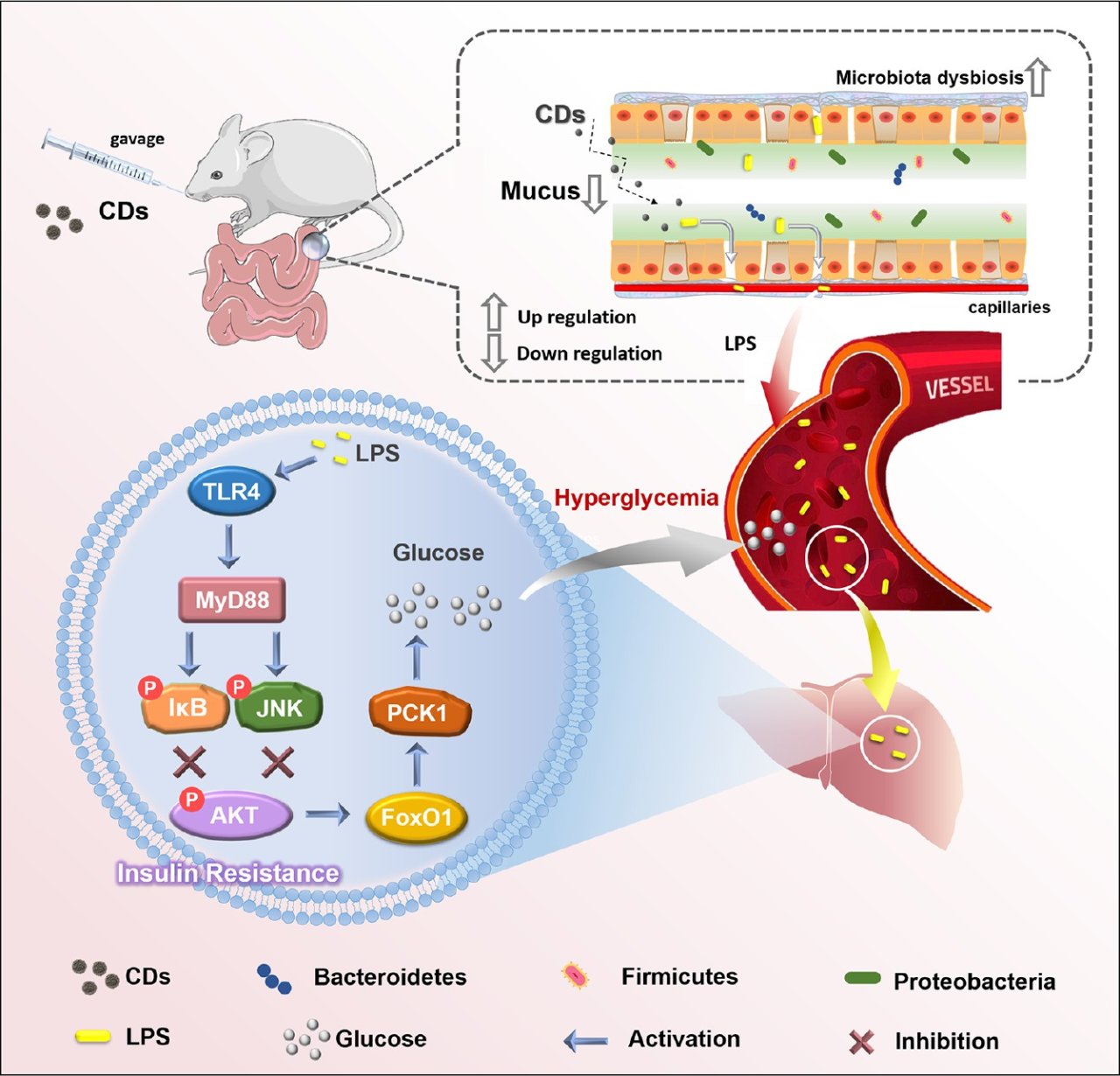
CD暴露通過影響腸道?肝軸破壞糖代謝示意圖
研究結果
1.補充益生菌可緩解CDs引起的葡萄糖穩態失衡、肝損傷及腸道菌群失調
在CDs處理14周后,小鼠出現高空腹血糖水平、糖耐量受損以及肝臟受損(肝脂肪變性、肝細胞空泡和肝纖維化鎖破裂增加),而補充益生菌的處理(CP組)提示可以恢復CDs引起的葡萄糖穩態失衡及肝損傷。
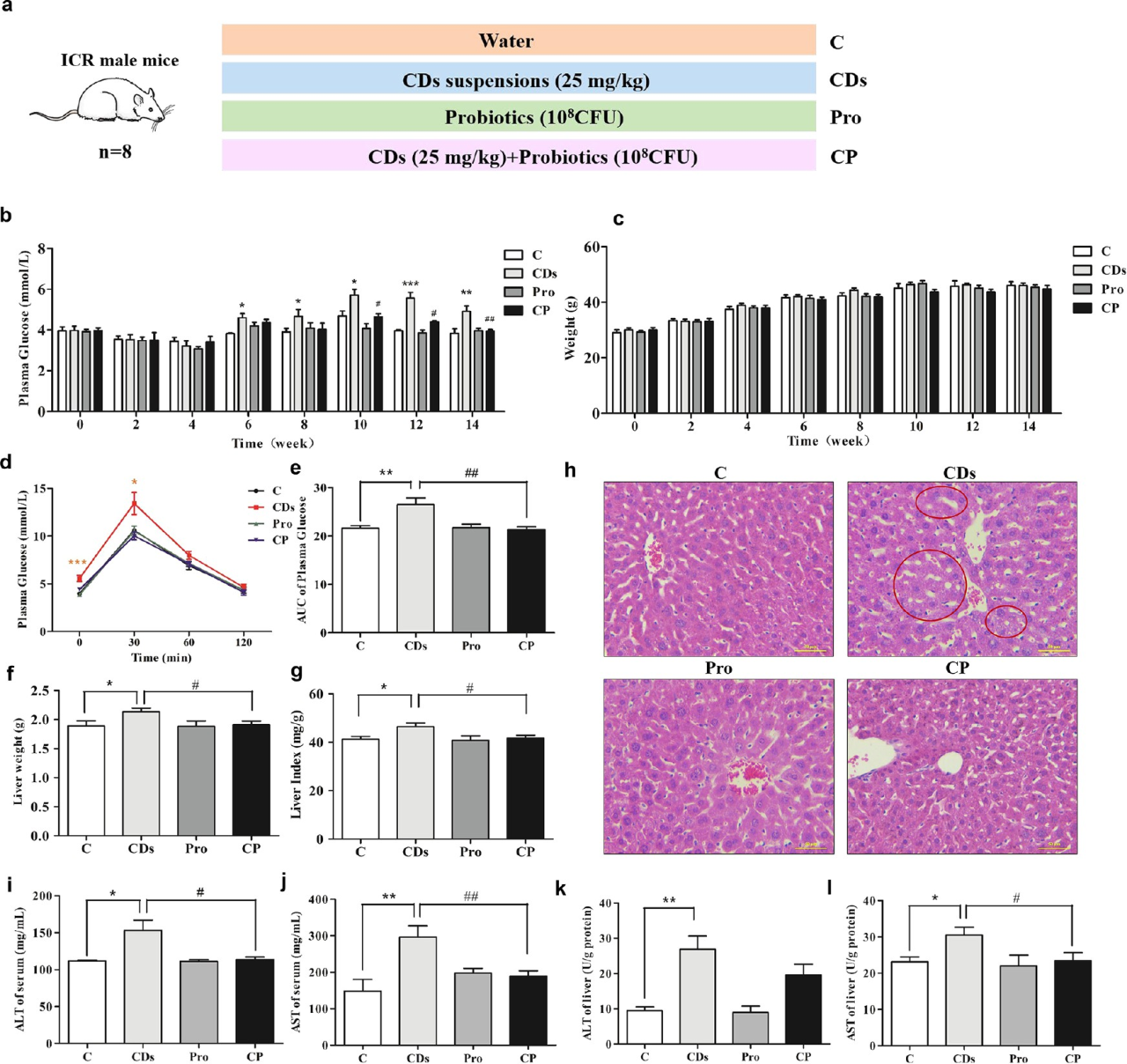
圖1 CD暴露對葡萄糖穩態和肝功能的影響
大量的研究已經表明,腸道微生物群在飲食誘導的Ⅱ型糖尿病(T2DM)中起著重要作用。因此,為了進一步探討CD對腸道微生物群的影響,作者采用不同處理小鼠結腸內容物進行16S rRNA基因測序。結果顯示在門水平上,CD組小鼠中菌群組成發生了明顯改變,如Bacteroidetes豐度降低、F/B(Firmicutes/Bacteroidetes)比率增加、Proteobacteria豐度增加和Coprococcus豐度降低等,這些菌群變化提示與全身炎癥或代謝綜合征相關。值得注意的是,所有CDs誘導的微生物群組成的改變都被膳食益生菌恢復。
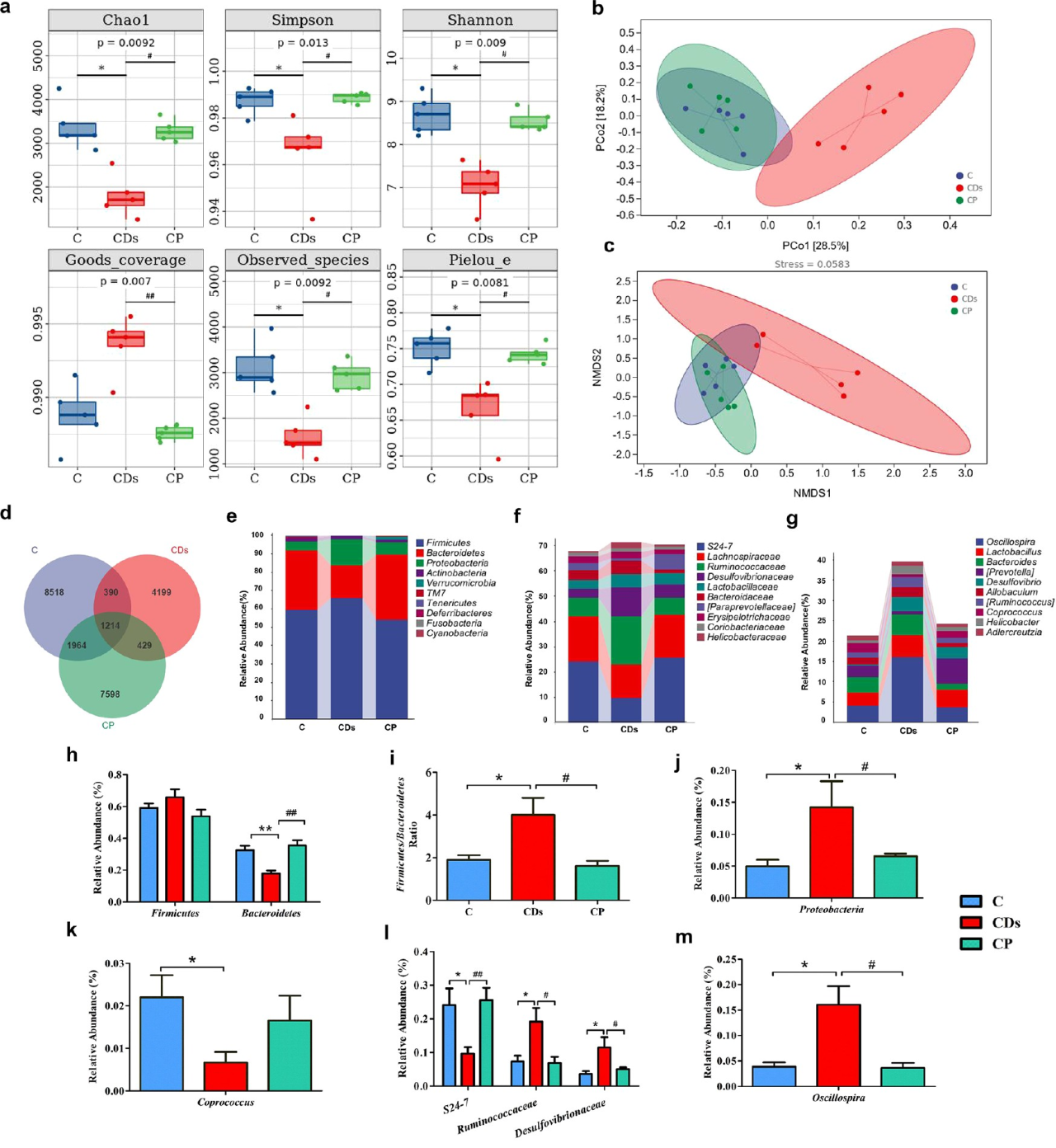
圖2 CD處理對腸道微生物群的影響和復雜益生菌的有益作用
2.CDs誘導的腸道菌群失調增加了腸道通透性且引起脂多糖相關的全身炎癥
LEfSe分析結果表明,CDs暴露增加了脫硫弧菌科(Desulfovibrionaceae)的豐度,可能引起脂多糖(LPS)水平升高,導致腸道黏液層被破壞。另一方面,結腸長度和隱窩深度是評估腸道炎癥的重要指標。研究結果顯示,益生菌可以防止CDs誘導的結腸長度縮短,并產生隱窩深度的強烈恢復趨勢,促進腸道炎癥的衰減。免疫熒光和Western blot結果證實了CD處理小鼠腸道黏液層被破壞。此外,糞便中LPS和硫化氫水平的增加驗證了Desulfovibrionaceae的負面影響。進一步在CD組中檢測到較高的血清LPS和TNFα,其與LPS易位及全身炎癥相關,而膳食益生菌可恢復這些癥狀。
3.補充益生菌可恢復CD介導的肝臟炎癥和胰島素抵抗
免疫學上,LPS與TLR4結合,激活適配器MyD88,觸發NF-κB和MAPK信號通路,從而增加促炎細胞因子的釋放。Western blot結果顯示,在CD組中,TLR4和MyD88表達水平升高,表明LPS被轉移到肝臟并激活了相關的免疫反應。此外,CD處理增加了IκB和p65-NFκB的磷酸化,促進肝臟炎癥,并通過磷酸化的JNK和p38進一步激活絲裂原活化蛋白激酶(MAPK)級聯反應。此外,CD處理降低了AKT的磷酸化,導致胰島素抵抗(IR),進而促進FOXO1和PCKI,促進糖異生。然而,補充益生菌幾乎使這些生物標志物恢復到正常水平。
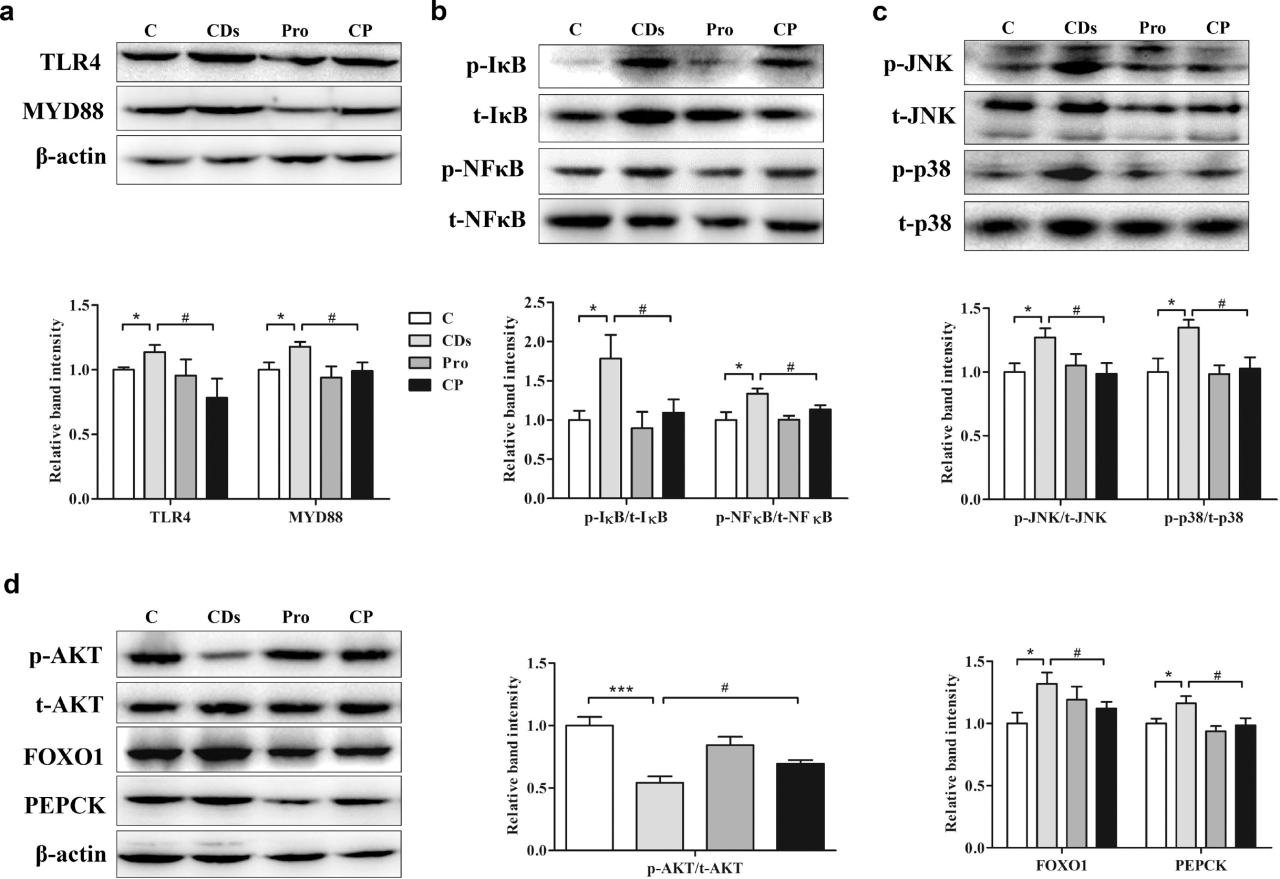
圖4 CD暴露對小鼠肝臟中TLR4/NF-κB/MAPK和IR信號轉導的影響
4.CD暴露通過影響腸?肝軸破壞糖代謝
采用糞菌移植(FMT)驗證CDs通過改變腸道微生物群來誘導小鼠IR。結果表明,FMT-CD組的空腹血漿和葡萄糖耐受不良明顯增加,而與FMT-C小鼠相比,空腹體重沒有變化。同時,接受CD小鼠腸道微生物群處理的受體小鼠血清、肝指數、肝功能指標均有明顯的升高趨勢。這些結果表明,葡萄糖代謝紊亂和肝功能損傷與腸道微生物群一起轉移到受體小鼠體內。
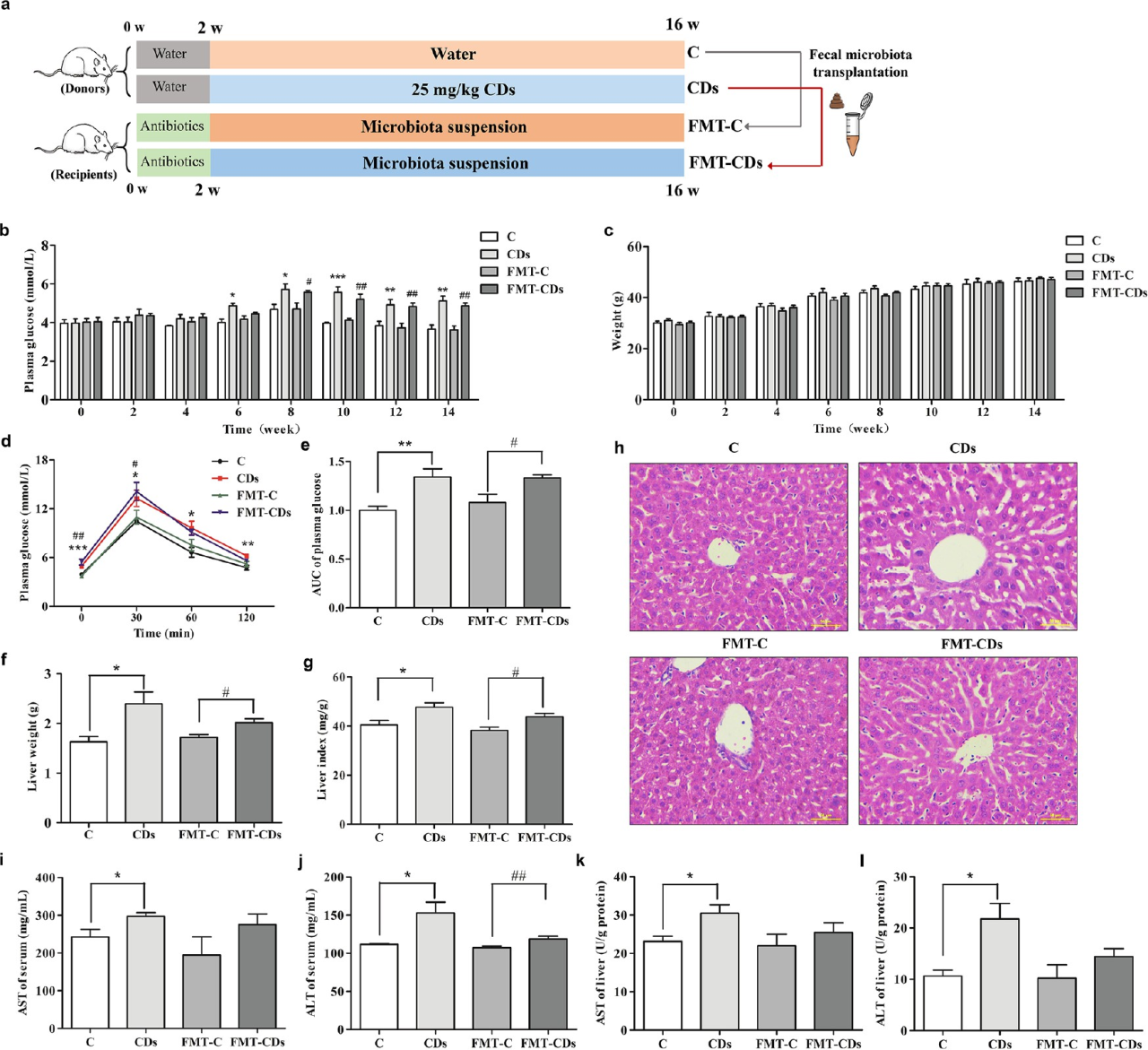
圖5 CD暴露小鼠的FMT誘導了受體小鼠的葡萄糖穩態紊亂
接下來,運用16s rRNA基因測序揭示FMT對小鼠腸道菌群的影響。測序結果顯示,FMT-C組和FMT-CD組之間的腸道菌群組成存在明顯差異。來自CD小鼠的FMT有改變腸道微生物群α多樣性的趨勢,這與供體小鼠相似。β多樣性結果顯示,FMT-CD小鼠的腸道微生物群從FMT-C中分離出來。腸道微生物組成分析也顯示了兩組受體小鼠之間的顯著差異。與FMT-C小鼠相比,來自CD小鼠的FMT增加了受體小鼠的腸道屏障通透性,以及與炎癥相關的生物學指標水平。然而,暴露于CD的微生物群耗竭小鼠的這些生物標志物水平與微生物群耗竭對照小鼠一致,這表明腸道微生物群失調是導致CD誘導的炎癥介導的胰島素抵抗的原因。
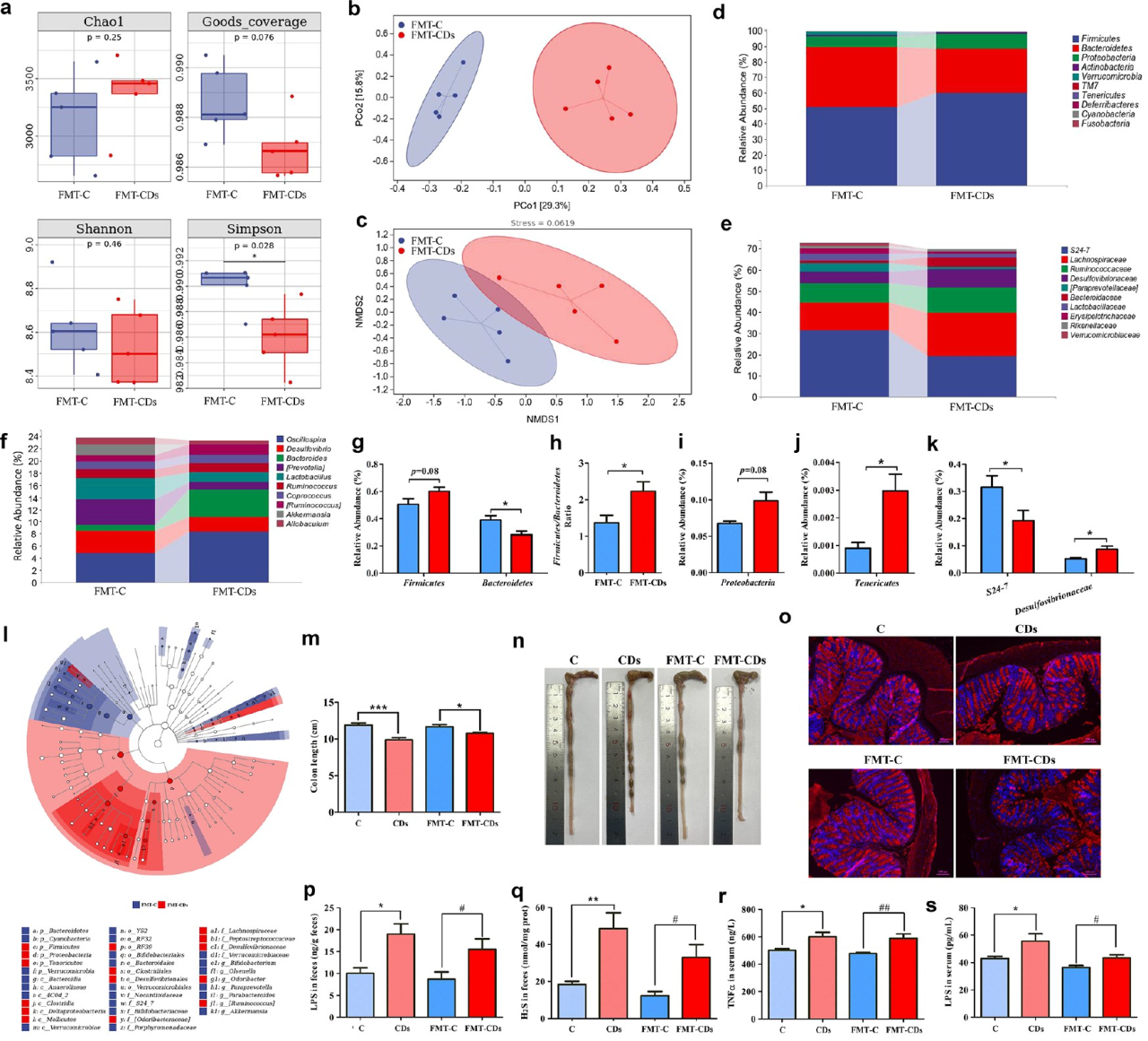
圖6 CD暴露小鼠的FMT誘導腸道微生物群失調并使受體小鼠的LPS轉移
研究結論
T2DM是一種嚴重的疾病,尤其是在發展中國家。最近的研究已經表明,飲食誘導的T2DM與腸粘液層、腸道微生物及其相互作用密切相關。上述工作表明,長期口服食源性CD會導致腸道微生物群失調,并破壞腸道屏障,進而導致全身炎癥和糖代謝紊亂,益生菌的保護作用則可使其恢復。此外,這些發現支持了改善腸道微生物群作為治療飲食誘導的T2DM的潛在策略的可能性。
文章索引:Zhang B, Fan X, Du H, et al. Foodborne Carbon Dot Exposure Induces Insulin Resistance through Gut Microbiota Dysbiosis and Damaged Intestinal Mucus Layer. ACS nano, 2023, 17(6): 6081-6094.