2023-12-05

《Journal of Hazardous Materials》
影響因子
13.6
新鄉醫科大學在國際著名雜志《Journal of Hazardous Materials》上發表了可見光驅動 C/O-g-C3N4 通過激活過二硫酸鹽有效滅活抗生素耐藥菌以及抑制抗生素耐藥基因轉化等相關研究機制。 本研究的轉錄組測序以及部分分析工作由上海派森諾生物科技股份有限公司完成。
技術路線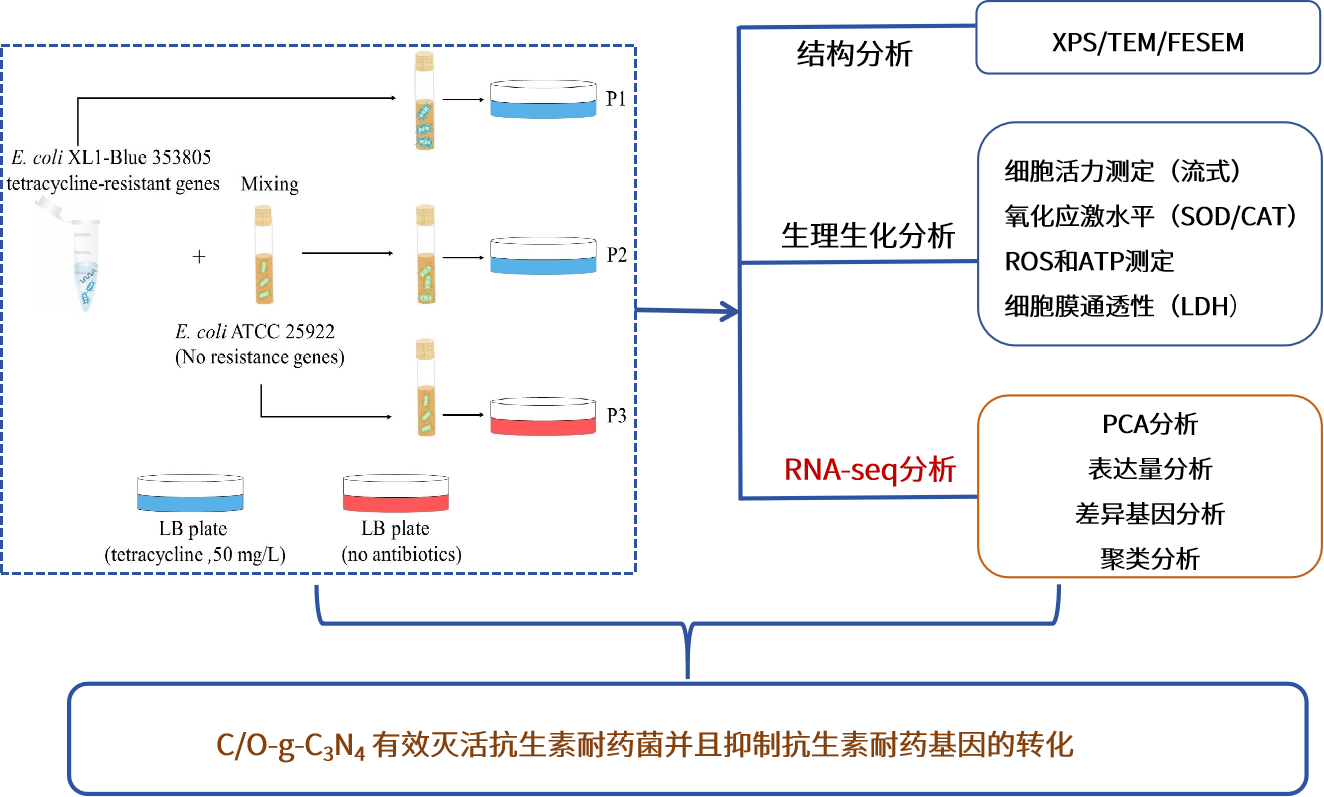
研究背景
抗生素在畜牧業、臨床醫學和水產品等多種領域的過度使用,嚴重威脅全球公共健康。近幾十年來,可見光催化已成為最有前景的消毒方法之一,它能產生高活性氧化物,氮化石墨(g-C3N4)由于其成本低、無毒等優點,在光催化消毒領域得到了廣泛的應用。然而,g-C3N4中光誘導載體的高度復合導致了較低的光催化效率。因此,尋找一種既能充分利用其優點又能減少其缺點的新型消毒工藝是非常有必要的。
研究材料與方法
1.實驗材料 耐四環素大腸桿菌 (XL1-Blue, 353805) 、大腸桿菌 (ATCC,25922) 2.測序平臺 Illumina NovaSeq 6000 3.分析方法 RNA-seq,FESEM,TEM,FCM等實驗
研究結果
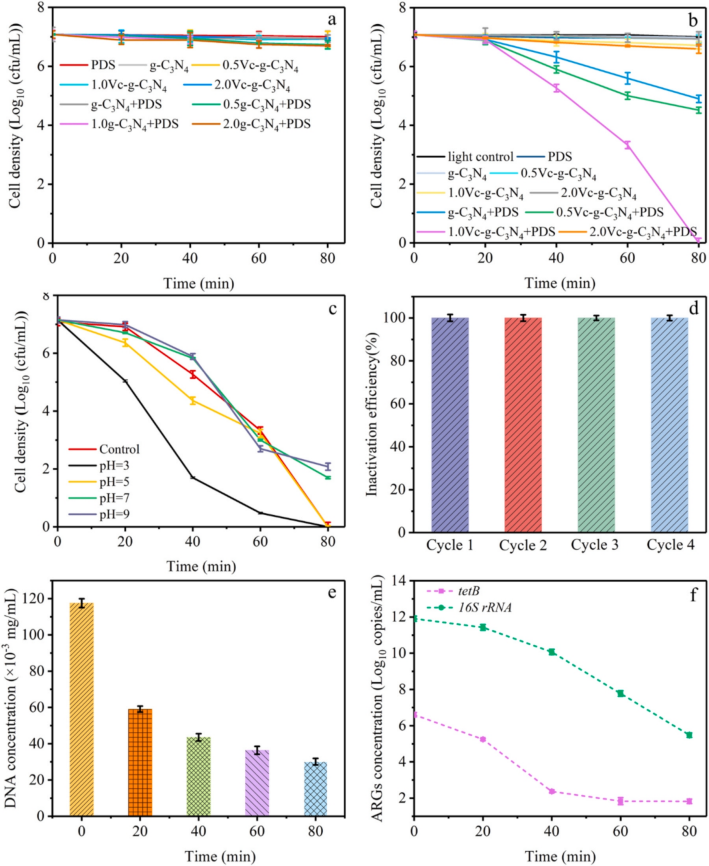
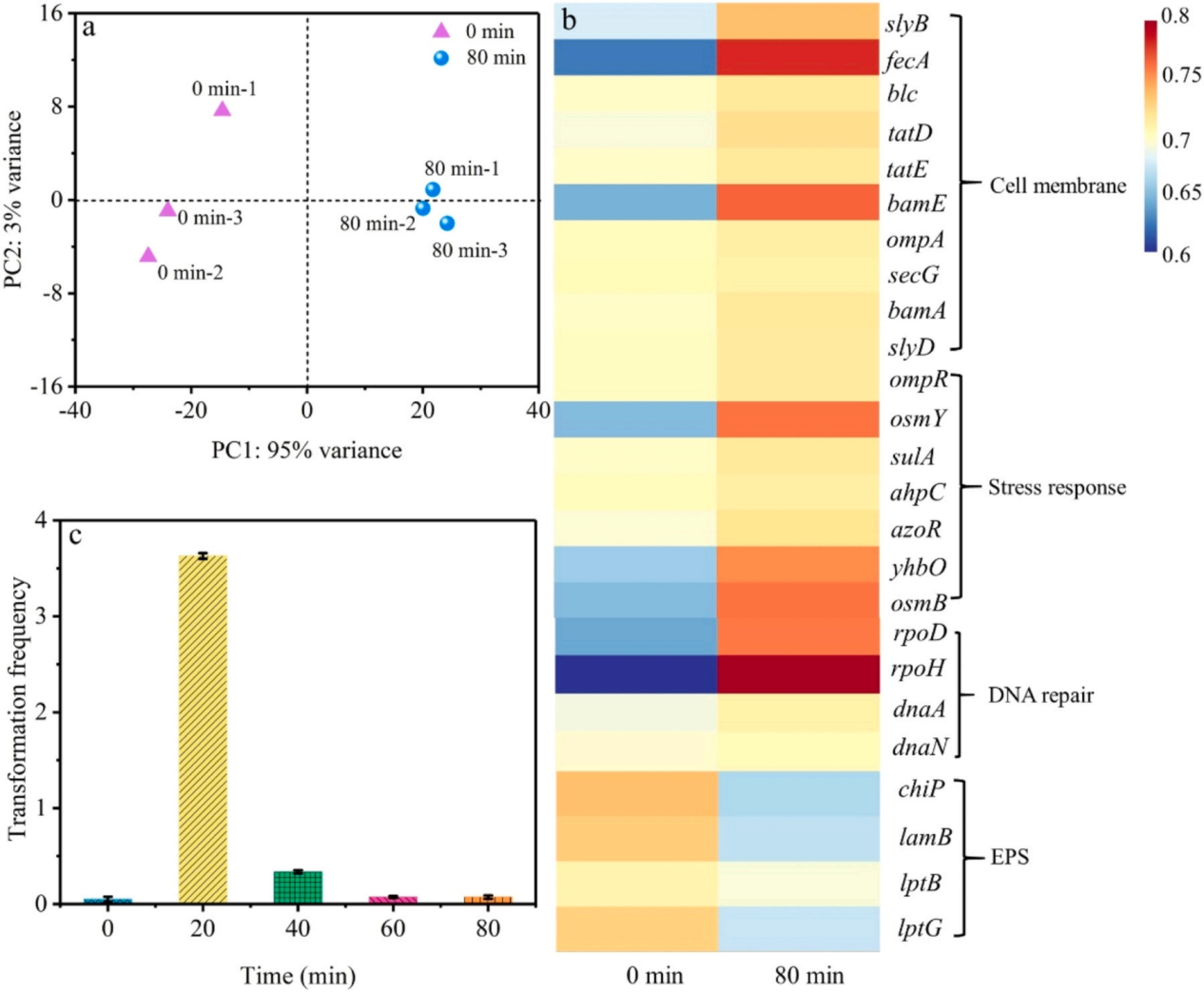
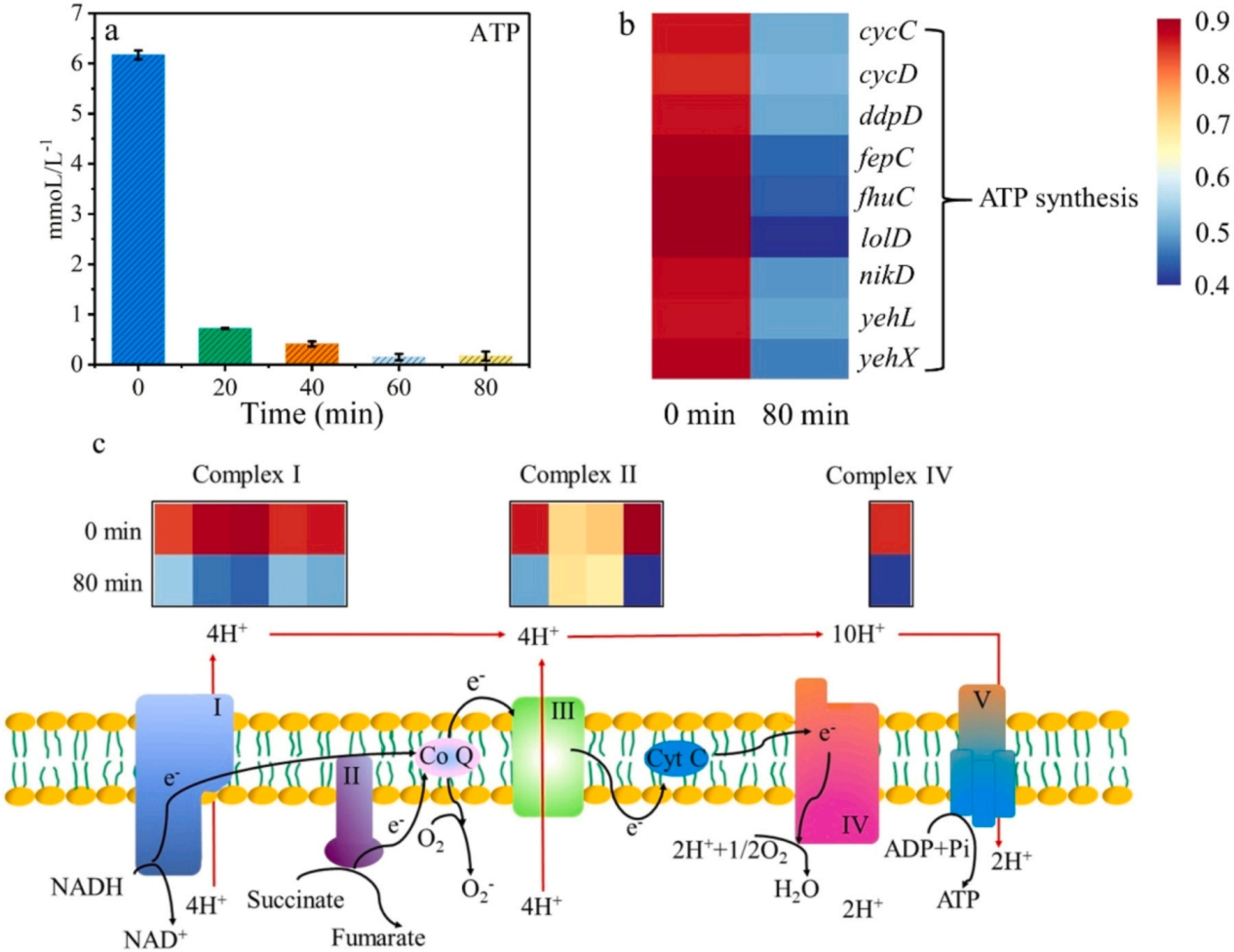
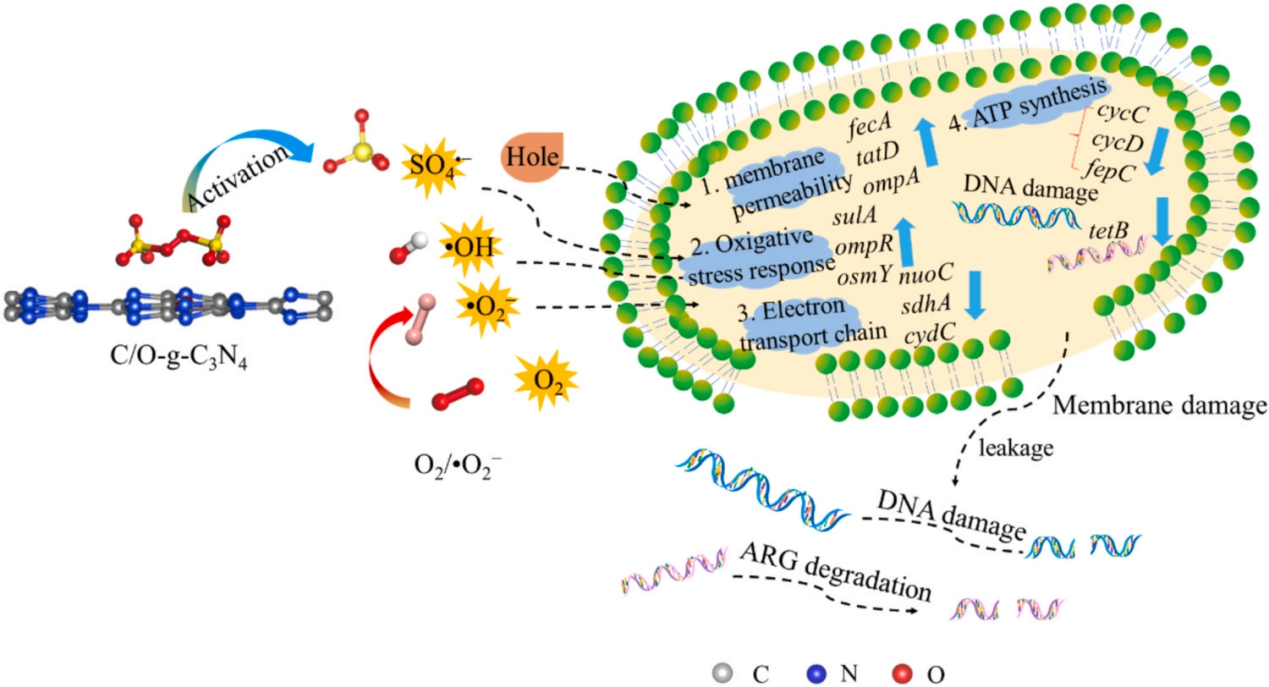
1.材料表征 利用XPS分析表明,所有樣品中都存在C、N和O元素,圖1a C1s 譜顯示,g-C3N4在284.8、286.0和288.5 eV處有三個峰,分別表示 C-C/C=C、C-O 、 N-C=N,其中 N-C=N含量由73.75%降至46.89%,C-O含量由8.15%升至22.52%,C-C/C=C含量顯著增加。在g-C3N4(圖1b)的N1s譜中,隨著Vc含量的增加,C/O-g-C3N4中C-N=C基團的含量減少。數據表明C-O的存在可能會改善C/O-g-C3N4和PDS體系的消毒效果。SEM結果顯示如圖2a所示,g-C3N4表現出厚實的體相結構,沒有氣孔,在1.0Vc-g-C3N4(圖2b)中觀察到了明顯的片狀結構和旺盛的氣孔。TEM進一步證實了從塊狀g-C3N4到超薄和多孔C/O-g-C3N4的變化(圖2C,d)。眾所周知,多孔結構可以提供大的比表面積和豐富的孔通道,為高效消毒提供更多的反應場所和高效的物質傳輸通道。 圖1 樣本的XPS譜圖 圖2 SEM和TEM圖像 2.ARB失活和ARGS消除 如圖3a所示,PDS或光催化劑本身對細菌幾乎沒有影響。g-C3N4、0.5Vc-g-C3N4、 1.0Vc-g-C3N4可以在80min內分別滅活4.94、4.43和7.02log的ARB。但隨著C和O含量的進一步增加,2.0Vc-g-C3N4表現出較差的失活效果。結果表明,適量的C和O顯著提高了細菌的滅活,而過度則對滅菌有不利,1.0Vc-g-C3N4表現出最好的滅活效果,導致細胞膜破裂和iDNA泄漏到外部環境中。另外瓊脂糖凝膠電泳顯示,隨著處理時間延長,靶基因條帶亮度逐漸降低,說明1.0Vc-g-C3N4能有效地損傷靶基因。 圖3 可見光對滅活大腸桿菌的影響 3.ARB的基因調控機制 研究者利用轉錄分析闡明了ARB的潛在失活機制。PCA圖顯示出樣本良好的重復性(圖4a)。利用熱圖展現與細胞膜、脅迫反應、細胞修復、DNA修復和細胞黏附等相關核心基因的表達水平(圖4b)。與細胞膜透性相關的基因顯著上調,表明處理后細胞膜透性增加。此外,1.0Vc-g-C3N4滅活體系中刺激了ROS應激反應。與脅迫反應相關的基因表達增加,表明大腸桿菌對1.0Vc-g-C3N4失活系統反應迅速。這些基因的過度表達可能是為了保護細胞免受ROS水平升高的影響。研究推測,細菌產生氧化應激來免受活性氧物種的攻擊,過度的氧化應激可能會導致細菌死亡。隨著滅菌時間的延長,轉化頻率降低。因此,較長的滅菌時間可以通過轉化有效地抑制ARGs。 圖4 轉錄組測序分析 圖5 ATP含量及相關合成基因 4.機制探索 實驗結果表明,1.0Vc-g-C3N4 在可見光條件下具有激活 PDS 和滅活細菌的卓越能力。與 -g-C3N4 相比,1.0Vc--g-C3N4 因其獨特的結構在可見光下激活 PDS 和滅活細菌的能力更強。首先,1.0Vc-g-C3N4 中摻雜 C 和 O 引起的電子重構增強了其對可見光的吸收。其次,由于 1.0Vc--g-C3N4 和 PDS 之間的強吸附作用,光電子從 1.0Vc--g-C3N4 快速轉移到 PDS。最后增加的比表面積和微孔結構,為 PDS 和大腸桿菌提供更多的活性位點。詳細的消毒機制如圖 9 所示。 圖6 C/O-g-C3N4針對ARB和ARGS激活PDS的示意圖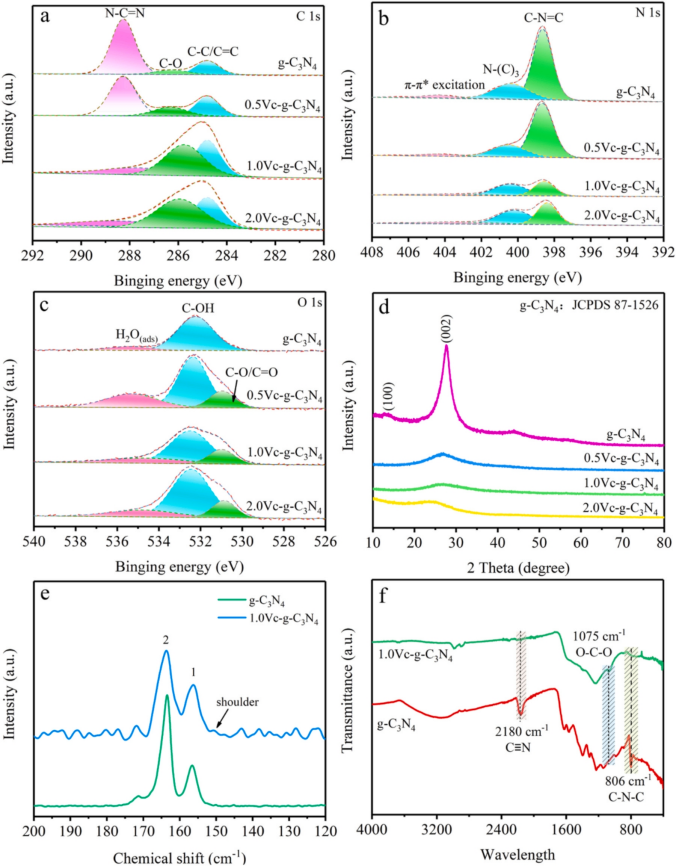

小 結
綜上所述,C和O的摻雜使g-C3N4在可見光照射下表現出良好的PDS活化性能和抗菌活性。與g-C3N4相比,1.0Vc-g-C3N4對PDS的吸附和活化效率更高,從而產生更多的活性物種。這些活性物種主要引起膜通透性的變化,使它們能夠進入細胞并損害細胞化合物,最終擾亂了電子傳遞鏈,阻礙了ATP的合成。此外,ARGs也被這些活性物質降解,抑制了ARGs的轉化。這些發現為研究新型g-C3N4催化劑與ARGs相關的環境風險提供了理論支持。


