
2023-08-29

《Advanced Science》
影響因子:15.1
文章題目:Chlorogenic Acid Ameliorates Post-Infectious Irritable Bowel Syndrome by Regulating Extracellular Vesicles ofGut Microbes
技術手段:16s;代謝組;蛋白組
南昌大學第二附屬醫院在《Advanced Science》上發表了綠原酸通過調節腸道微生物的細胞外囊泡改善感染后腸易激綜合癥。
本研究的蛋白組、代謝組和16s的測序及部分數據分析工作由上海派森諾生物科技股份有限公司完成。
研究背景
感染后腸易激綜合征(PI-IBS)發生于急性感染性腹瀉后,其發病機制可能與生物失調有關。人類腸道復雜的微生物群直接或間接地影響著宿主的健康。本文研究了綠原酸(CGA)在緩解大鼠PI-IBS中的作用,這是一種具有多種藥理特性的天然化合物。直腸給藥CGA通過調節腸道菌群及其代謝產物緩解PI-IBS,闡明腸道菌群在PI-IBS發病機制中起關鍵作用。添加CGA顯著提高了糞便中產酸擬桿菌的豐度和甘氨酸水平。原核細胞和真核細胞之間的生物信號交換主要是通過細胞外囊泡(EVs)的分泌,甘氨酸結構改變Bacteroides acidifaciens 胞外囊泡(EVs)并富集胞外囊泡中的功能蛋白;甘氨酸誘導的EVs通過減輕腸道臟器炎癥和超敏反應,維持黏膜屏障功能從而減輕PI-IBS。因此,CGA通過腸道微生物群及其代謝產物介導來緩解PI-IBS。本研究提出了一種腸道微環境與宿主之間信號交換的新機制。
技術路線
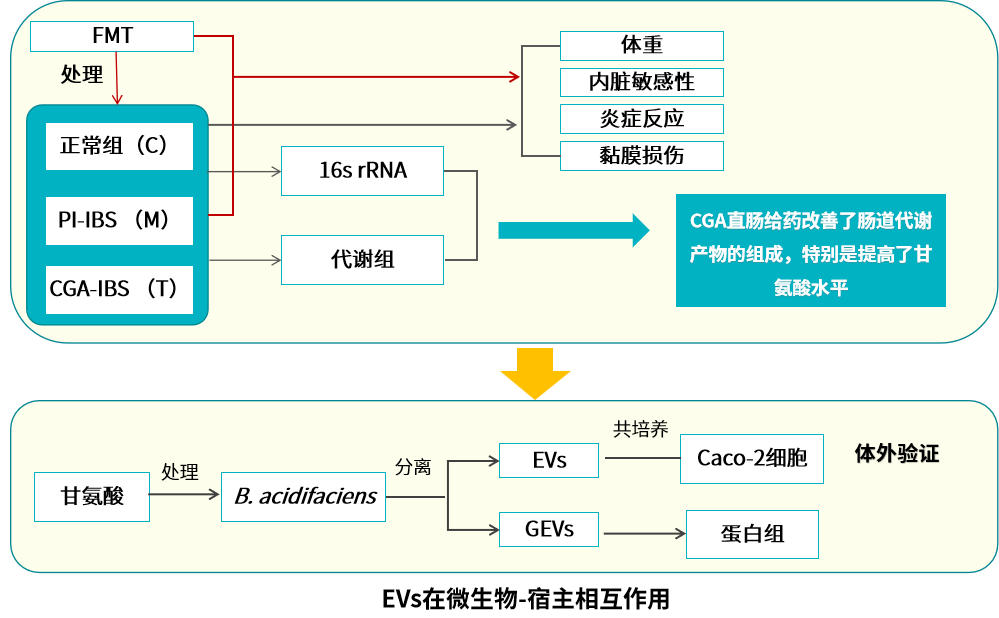
研究結果
1. PI-IBS大鼠腸道菌群紊亂的觀察
構建大鼠PI-IBS模型,發現PI-IBS大鼠,體重顯著降低、內臟敏感性增加(圖1D)。白細胞介素(IL)?1??、IL-6和腫瘤壞死因子(TNF)-??的表達在PI-IBS大鼠(M組)顯著升高(圖1E-J)。aa刺激大鼠肌球蛋白輕鏈激酶(MLCK)和磷酸化肌球蛋白輕鏈(p-MLC)的上調和腸上皮TJ蛋白(ZO-1, occludin)的下調(圖1K,L)。PI-IBS大鼠腸道通透性增強(圖1M)。
通過16S rRNA基因測序,探討了正常組(C)和PI-IBS組的腸道菌群組成的差異。在門水平上,兩組糞便微生物群樣本中Firmicutes、Bacteroidetes和Proteobacteria均為優勢門;在屬水平上,兩組均以Lactobacillus、Ruminococcaceae和Lachnospiraceae為主;在物種水平上,B. acidifaciens, Akkermansia muciniphila和Pseudomonas xiamenensis 在PI-IBS組中減少,而Staphylococcus lentus的豐度顯著增加(圖1P-R)。上述結果揭示,4%AA聯合束縛應激可導致大鼠內臟敏感、炎癥反應、腸道黏膜屏障損傷和腸道菌群紊亂。
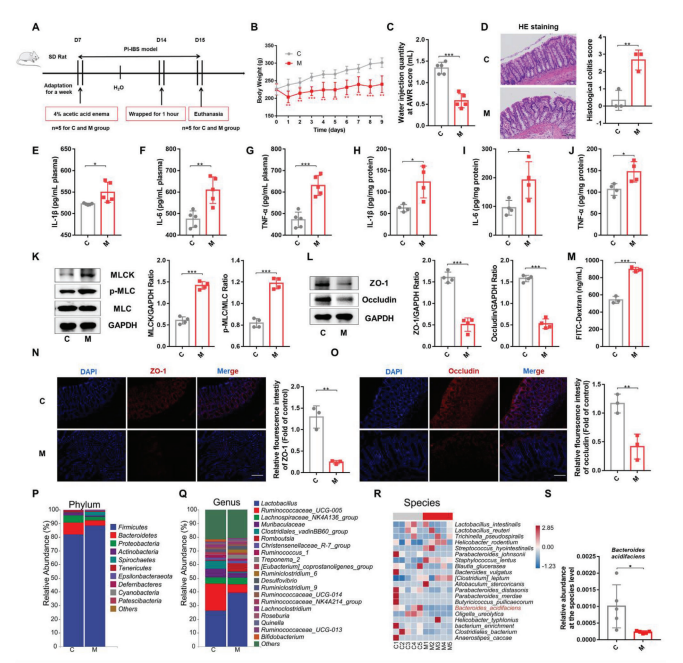
圖1直腸給藥AA誘導大鼠PI-IBS并引起腸道菌群紊亂
2、直腸給藥CGA減輕AA誘導的大鼠PI-IBS
為研究CGA的作用,PI-IBS大鼠直腸給藥CGA 1周。與PI-IBS大鼠(M組)相比,CGA治療后顯著減輕PI-IBS大鼠內臟敏感性、炎癥反應及黏膜損傷(圖2)。
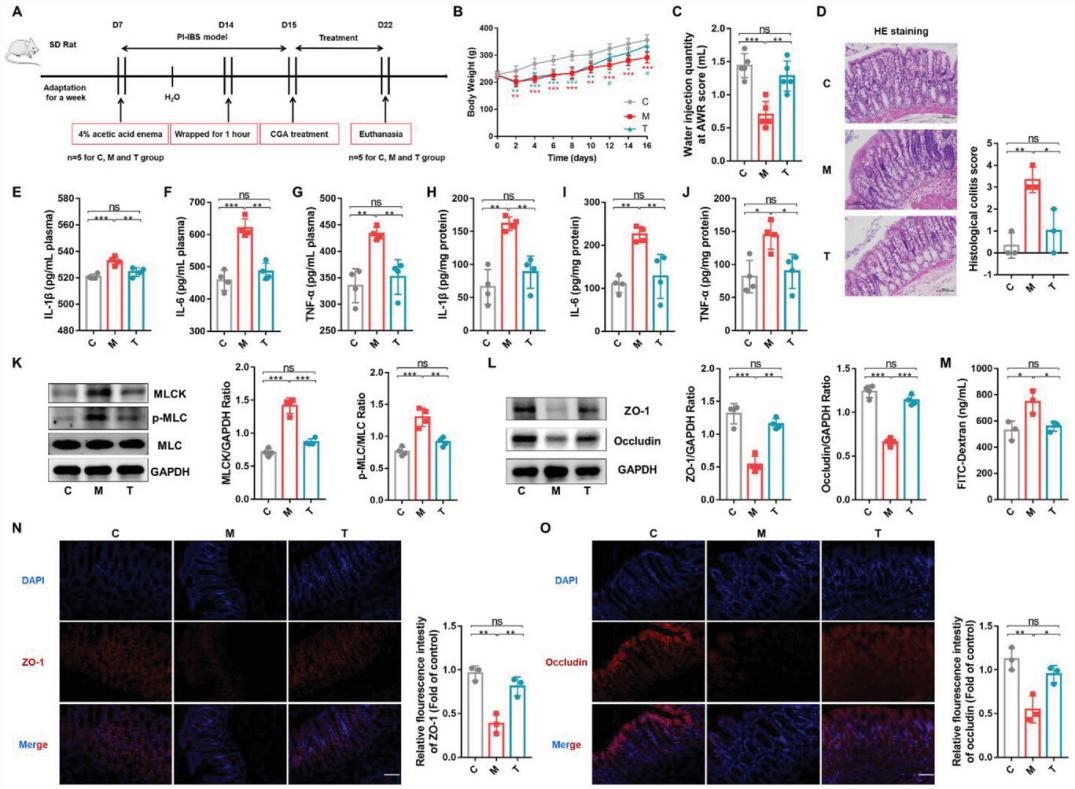
圖2 直腸給藥CGA減輕AA誘導的大鼠PI-IBS
3、CGA糞菌移植(FMT)減輕大鼠PI-IBS癥狀
通過將PI-IBS大鼠直腸給藥后的糞便菌群移植給受體大鼠來驗證CGA暴露的腸道菌群對PI-IBS的影響。與正常大鼠(KC)和給藥CGA(KT)組相比,PI-IBS糞便(KM)組體重下降(圖3B),內臟敏感性升高(圖3C)。炎癥細胞浸潤了KM組的結腸組織(圖3D)。與KM組相比,KC組FMT后癥狀有所緩解,其中KT組癥狀改善最為顯著。結果表明,CGA處理大鼠的糞便移植可抑制PI-IBS模型中內臟敏感性增加、炎癥反應和腸黏膜屏障受損。因此,CGA對PI-IBS模型的緩解作用可能是通過調節腸道菌群或其代謝產物來介導的。
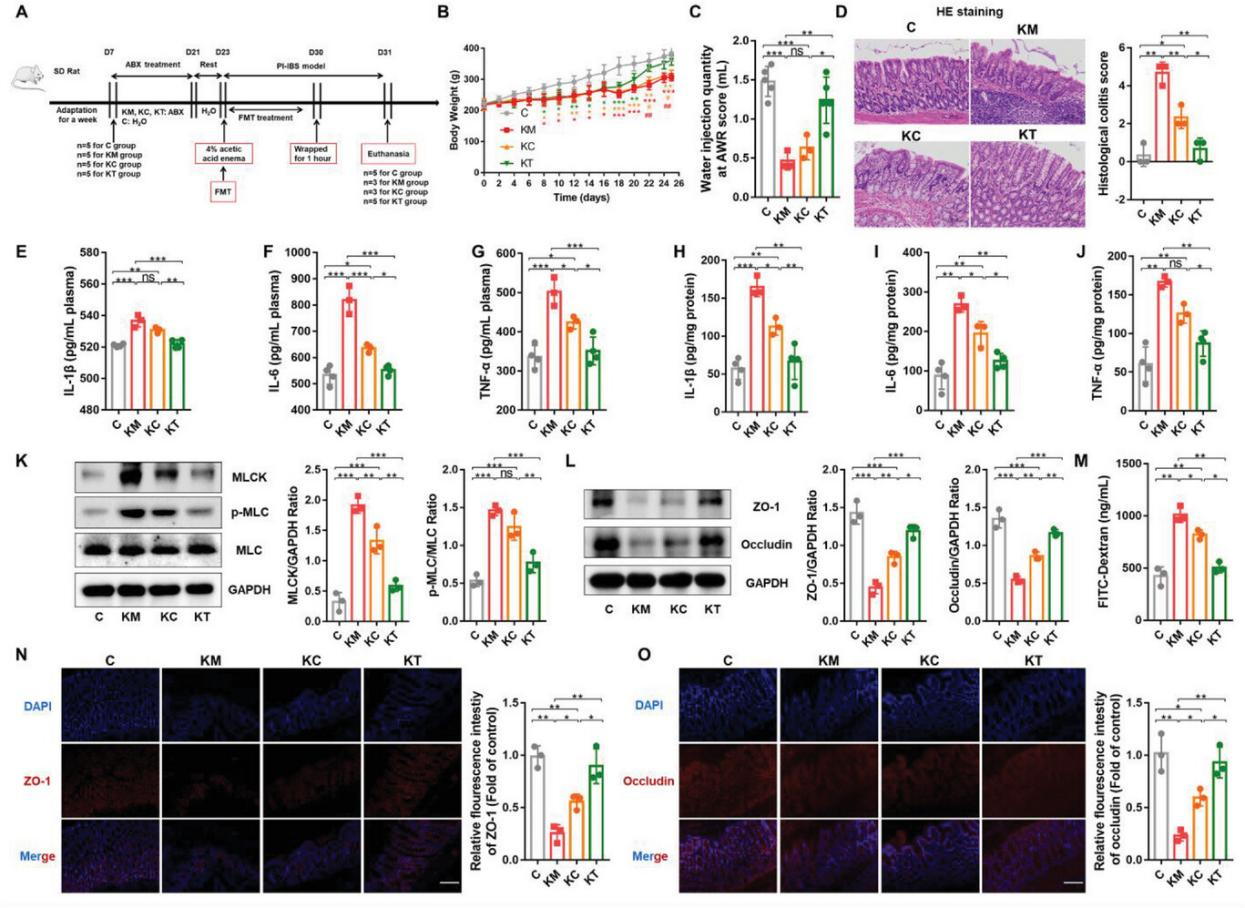
圖3 CGA-FMT減輕大鼠PI-IBS癥狀
4、CGA挽救了PI-IBS大鼠腸道產酸擬桿菌的損失和甘氨酸水平
通過對大鼠糞便微生物進行16S rRNA基因測序法。發現在門水平上, Firmicutes, Bacteroidetes和 Proteobacteria是糞便微生物群樣本中的優勢門(圖4E)。在屬水平上,糞便微生物群以Muribaculaceae, Lactobacillus和 Prevotella為主(圖4F)。在物種水平上,Lactobacillus intestinalis, L. reuteri,和 Allobaculum stercoricanis 是糞便微生物群中的優勢種(圖4G)。
通過對PI-IBS和CGA處理的大鼠糞便樣本進行了非靶向代謝組學分析。在PI-IBS大鼠中鑒定出了24種代謝物。10種表達下調,14種表達上調(圖4I)。KEGG富集結果表明,這些代謝產物主要參與氨基酸相關代謝,包括纈氨酸、亮氨酸和異亮氨酸的生物合成和降解 (圖4J)。對24種代謝物進行分類,發現17.376%、16.667%和15.957%的代謝物分別為脂類、碳水化合物和氨基酸(圖4K)。進一步分析了兩組間顯著不同水平的氨基酸,發現CGA處理的大鼠與PI-IBS處理的大鼠相比,甘氨酸含量顯著增加。這些結果表明,CGA直腸給藥改善了腸道代謝產物的組成,特別是提高了甘氨酸水平。
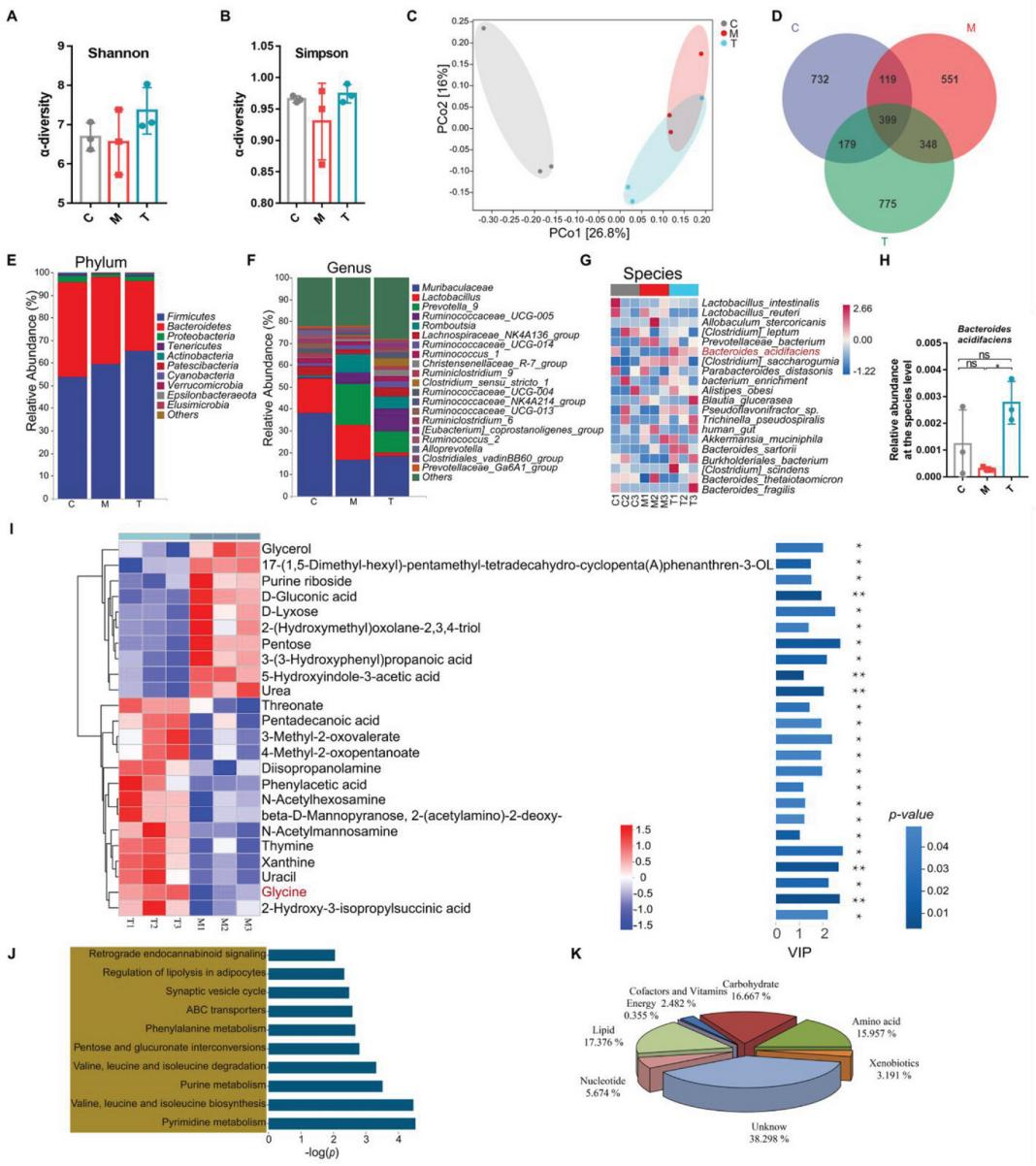
圖4 CGA增加了PI-IBS大鼠腸道產酸擬桿菌的豐度和甘氨酸水平
5、甘氨酸誘導的EVs (GEVs)恢復體外結腸上皮屏障功能
為了進一步研究EVs在微生物-宿主相互作用中的作用,將EVs與Caco-2細胞共孵育后,紅色dil信號被細胞吸收并在核周區積累(圖5B)。研究發現EVs抑制了Caco-2細胞中MLCK/p-MLC信號通路關鍵蛋白表達(圖5C),促進了細胞間TJ蛋白(ZO-1和occludin)表達(圖5D)。免疫熒光技術在Caco-2細胞中也得到了相同的結果(圖5E和F)。此外,甘氨酸可以誘導B. acidfaciens EVs的形成,EVsv和GEVs均可進入Caco-2細胞,但GEVs比EVs更能促進腸上皮屏障功能的修復。
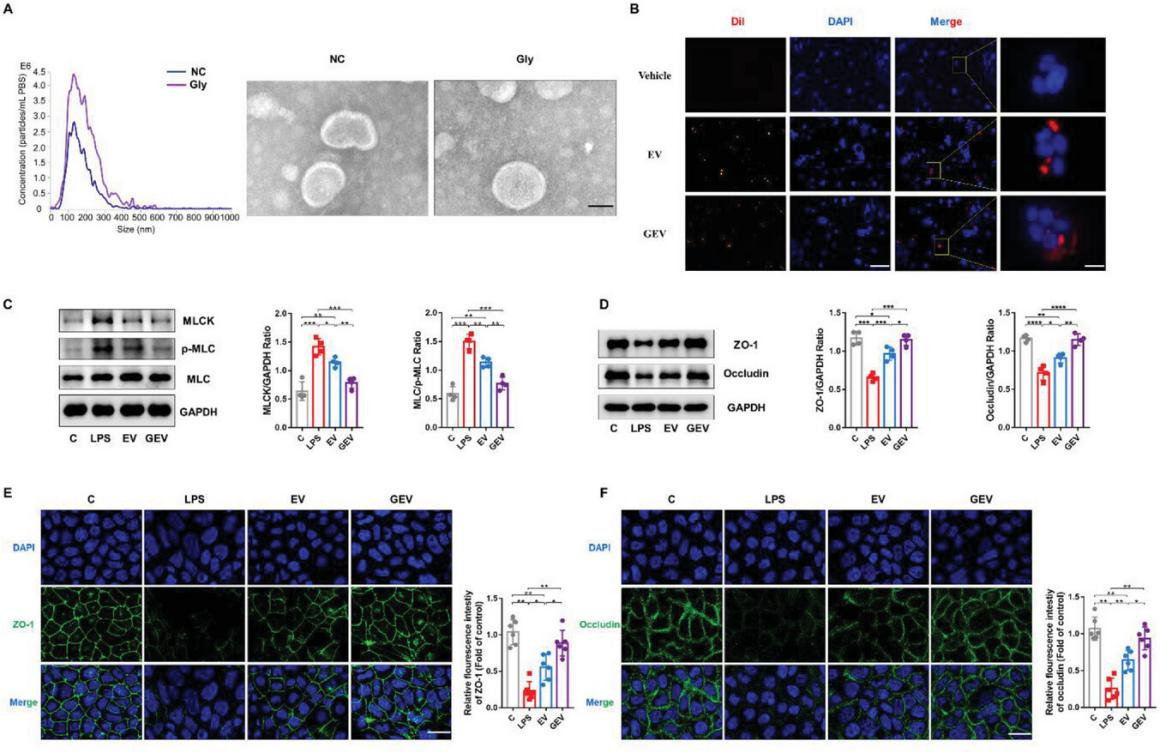
圖5 甘氨酸誘導的產酸擬桿菌 EVs對體外結腸上皮屏障功能的恢復作用
6、甘氨酸通過改變產酸擬桿菌EVs的蛋白譜改善大鼠PI-IBS癥狀
與EV組相比,GEVs顯著減輕PI-IBS大鼠的體重,增強了內臟敏感性(圖6B、C)。GEVs在降低促炎因子(IL-1??、IL-6和TNF-??)水平方面的作用更顯著(圖6F-K)。MLCK/p-MLC信號通路蛋白、腸上皮間質TJ蛋白(ZO-1和occludin)和血清FITC-dextran水平顯示,GEVs在增強粘膜屏障完整性方面的作用更為明顯(圖6L-N)。
之后,對非甘氨酸誘導(EVs)和甘氨酸誘導(GEVs)的EV進行了蛋白質組學分析,添加甘氨酸導致208個差異表達蛋白(DEPs)上調,183個差異表達蛋白下調(圖6Q)。GO富集分析表明,DEPs主要集中在細菌的生物過程中。KEGG途徑分析表明,GEVs的DEPs主要上調了一些氨基酸代謝相關途徑,包括丙氨酸、天冬氨酸和谷氨酸代謝、泛酸和輔酶a的生物合成以及苯丙氨酸、酪氨酸和色氨酸的生物合成,表明甘氨酸最有可能影響EVs代謝。此外,甘氨酸下調了EVs中常見的信號通路PI3K/Akt信號通路、FoxO信號通路和MAPK信號通路-fly,并影響膽汁酸代謝,包括二級膽汁酸生物合成和初級膽汁酸生物合成,由此可見,與未誘導的EVs相比,GEVs的蛋白質組成發生了巨大的變化,最終改變了其生物學功能。
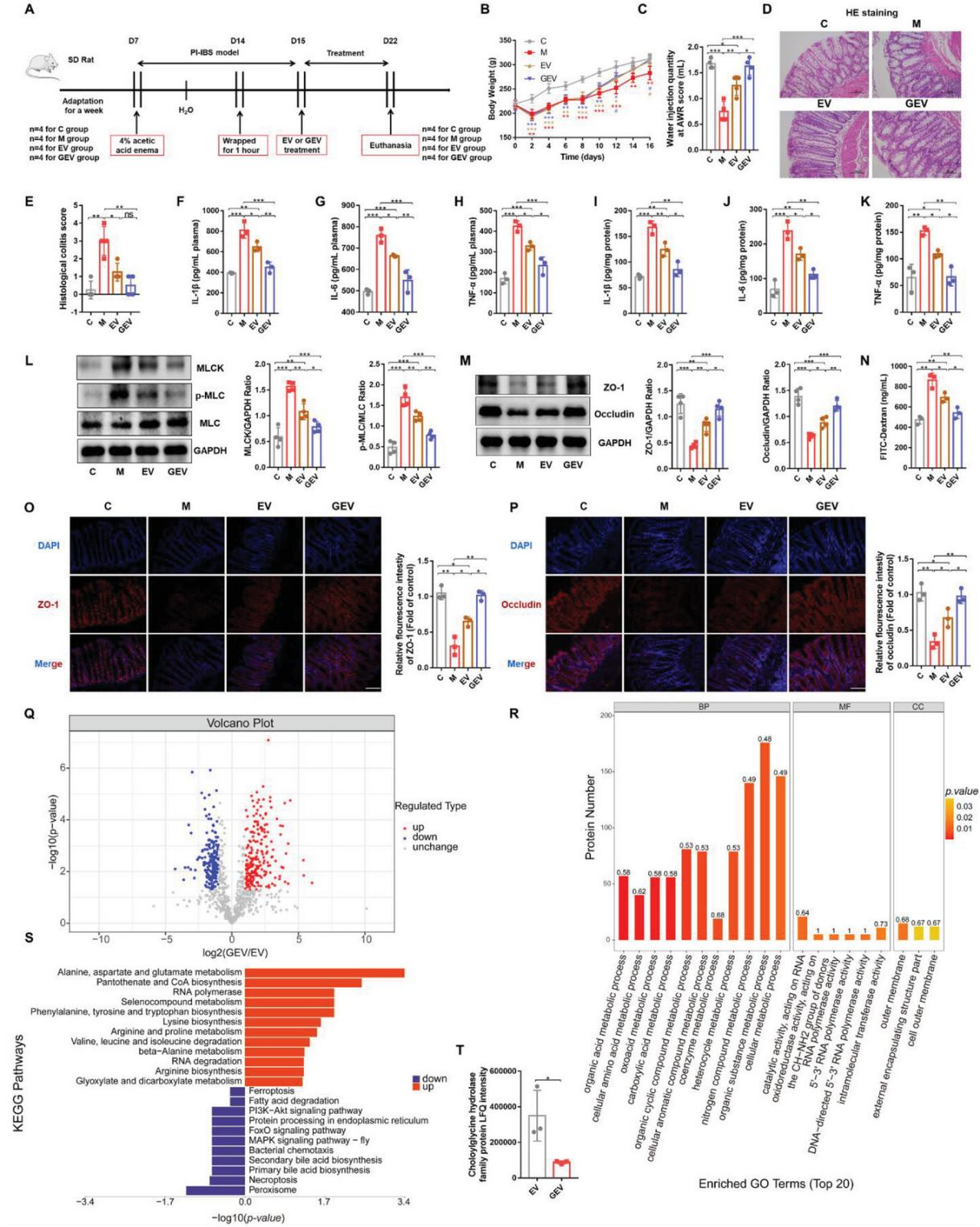
圖6甘氨酸通過改變產酸擬桿菌EVs的蛋白譜改善大鼠PI-IBS癥狀
結 論
這項研究中,研究了腸道菌群在PI-IBS大鼠模型中的作用,證實了CGA對PI-IBS癥狀有緩解作用。使用16S核糖體RNA (rRNA)基因測序和非靶向代謝組學篩選可能與CGA對PI-IBS癥狀影響相關的候選細菌和代謝物,并通過候選細菌(B. acidifaciens)和代謝物(glycine)移植驗證結果。體外實驗表明,細菌EVs可能是B. acidfaciens和甘氨酸之間的潛在聯系。最后,確定腸道菌群產生的EVs在PI-IBS大鼠的炎癥反應、腸道內臟超敏反應和粘膜屏障功能的發展中發揮調節作用,是由特定的代謝物誘導的。對非甘氨酸誘導(EVs)或甘氨酸誘導(GEVs)的EV進行了蛋白質組學分析,證明了甘氨酸誘導的產酸擬桿菌 EV可以緩解PI-IBS癥狀并進入腦組織發揮潛在的調節作用(圖7)。
原文索引:
Zheng, C., Zhong, Y., Zhang, W., Wang, Z., Xiao, H., Zhang, W., Xie, J., Peng, X., Luo, J., Xu, W., Chlorogenic Acid Ameliorates Post-Infectious Irritable Bowel Syndrome by Regulating Extracellular Vesicles of Gut Microbes. Adv. Sci. 2023, 2302798. https://doi.org/10.1002/advs.202302798