
2023-08-11

《Nature communications》 影響因子:16.6 最近,華中農業大學在《Nature communications》發表了題為“Cooperative microbial interactions drive spatial segregation in porous environments”的論文。文中指出孔隙環境中浮游微生物與生物膜微生物之間的相互作用會促使微生物群落空間分化。研究證明了生物膜形成能力較弱的Arthrobacter通過去除生物膜形成抑制分子D型氨基酸,促進Pseudomonas在固相表面定植形成生物膜。同時,生物膜在形成過程中分泌的公共代謝產物,則會提高Arthrobacter在流體環境中的生長與繁殖。這種互惠型合作關系促使Arthrobacter與Pseudomonas能夠在群落定植初期分別快速占據流體環境和固相表面,進而誘導孔隙環境中微生物群落的空間組裝與分布。上述研究結果為土壤和沉積物等孔隙環境中微生物群落的組裝和演替提供了新的見解。 以上研究的16S rRNA擴增子測序,微生物基因組測序,微生物轉錄組測序,非靶向代謝組檢測和部分數據分析工作由上海派森諾生物科技股份有限公司完成。
研究背景 土壤和沉積物等孔隙環境是地球上微生物的主要棲息地。在這些孔隙環境中,微生物通過分泌胞外聚合物相互粘結形成具有多細胞結構的生物膜。與浮游狀態的細胞相比,生物膜內的細胞具有更強的環境適應能力和獨特的生態功能等特征。因此,揭示生物膜形成與功能發揮機制對于維護微生物生態系統、保障環境健康、支撐綠色發展至關重要。在生物膜形成過程中,微生物通過相互作用形成具有一定空間組織結構的生物膜群落,但微生物之間復雜的相互作用如何調控生物膜群落的組裝和空間分布仍不清楚。基于上述背景,研究團隊自主構建了具有微柱陣列的土壤微流控芯片,解析了孔隙環境中土壤生物膜群落的組裝過程,為土壤和沉積物等孔隙環境中微生物群落的組裝和演替提供了新的見解。
研究方法 研究者開發了一種微柱陣列的微流控芯片模擬多孔環境(圖1a)。取稻田土壤深度為0-20 cm,離心分離土壤微生物,并抽提土壤萃取液制作土壤微生物提取強化培養基(ISEM)。通過微流控培養、16S rRNA擴增子測序、qPCR、FISH、代謝組學、微生物分離純培養等實驗手段分析多孔環境中生物膜形成和微生物群落空間分化機制。
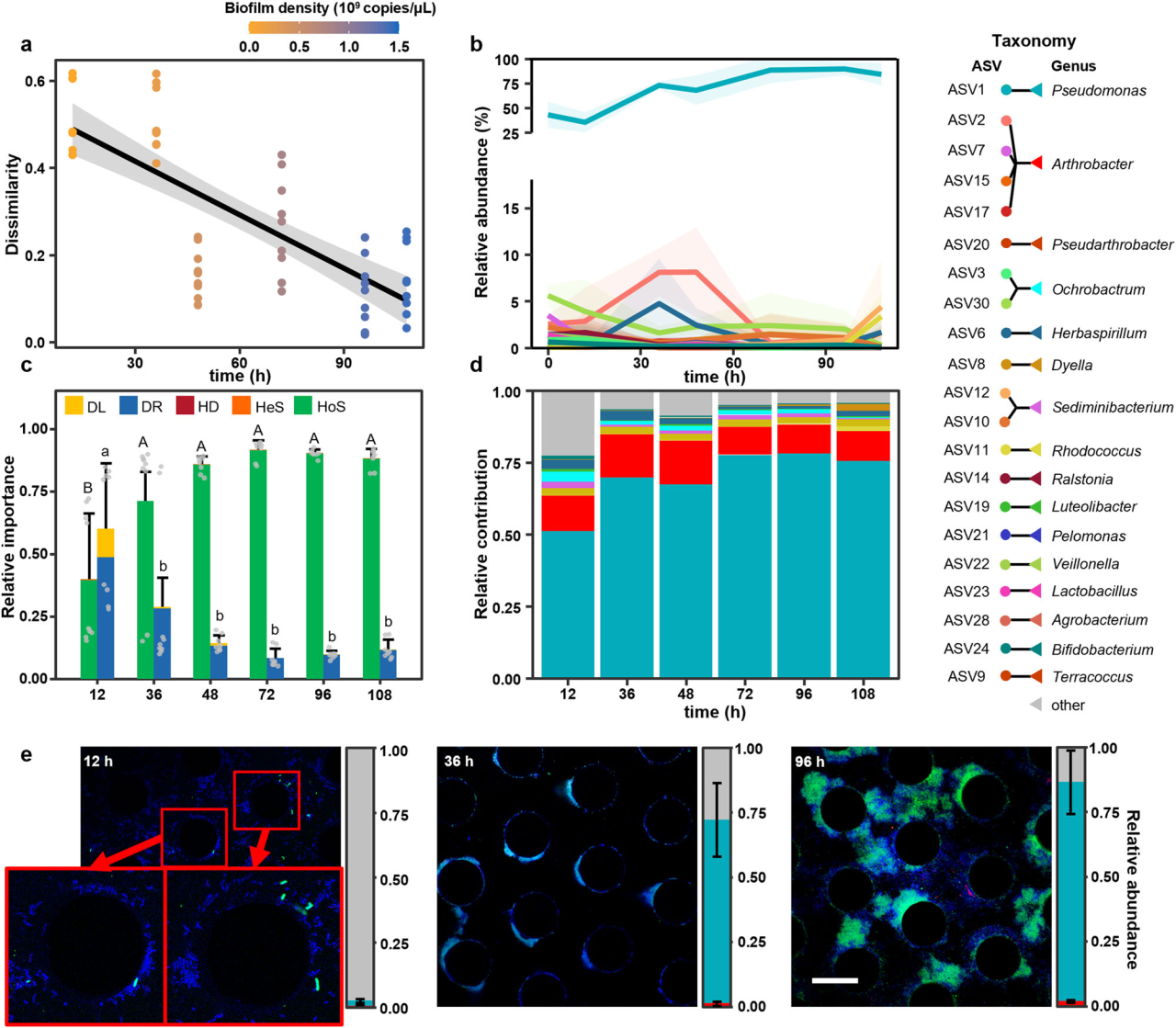
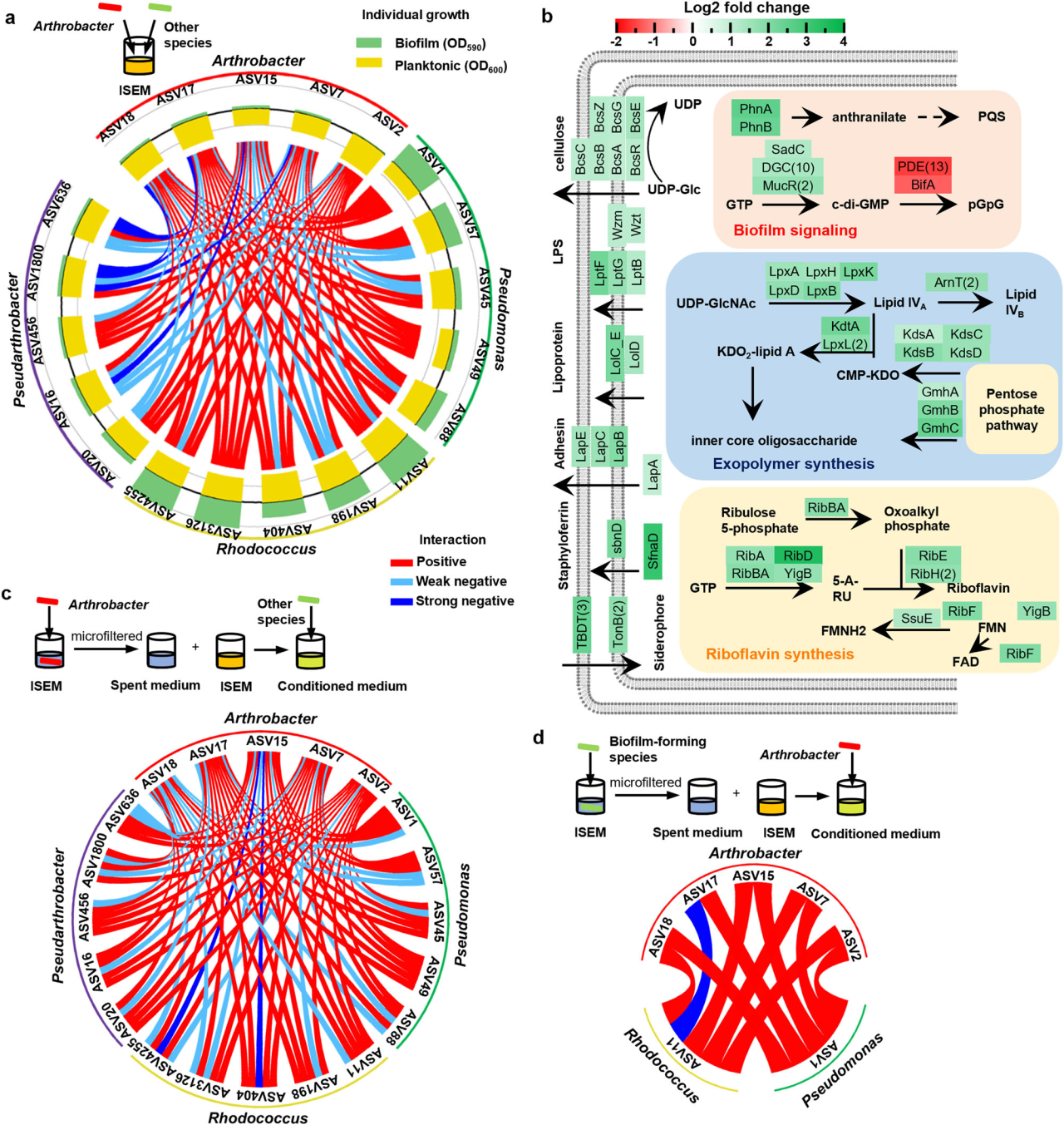
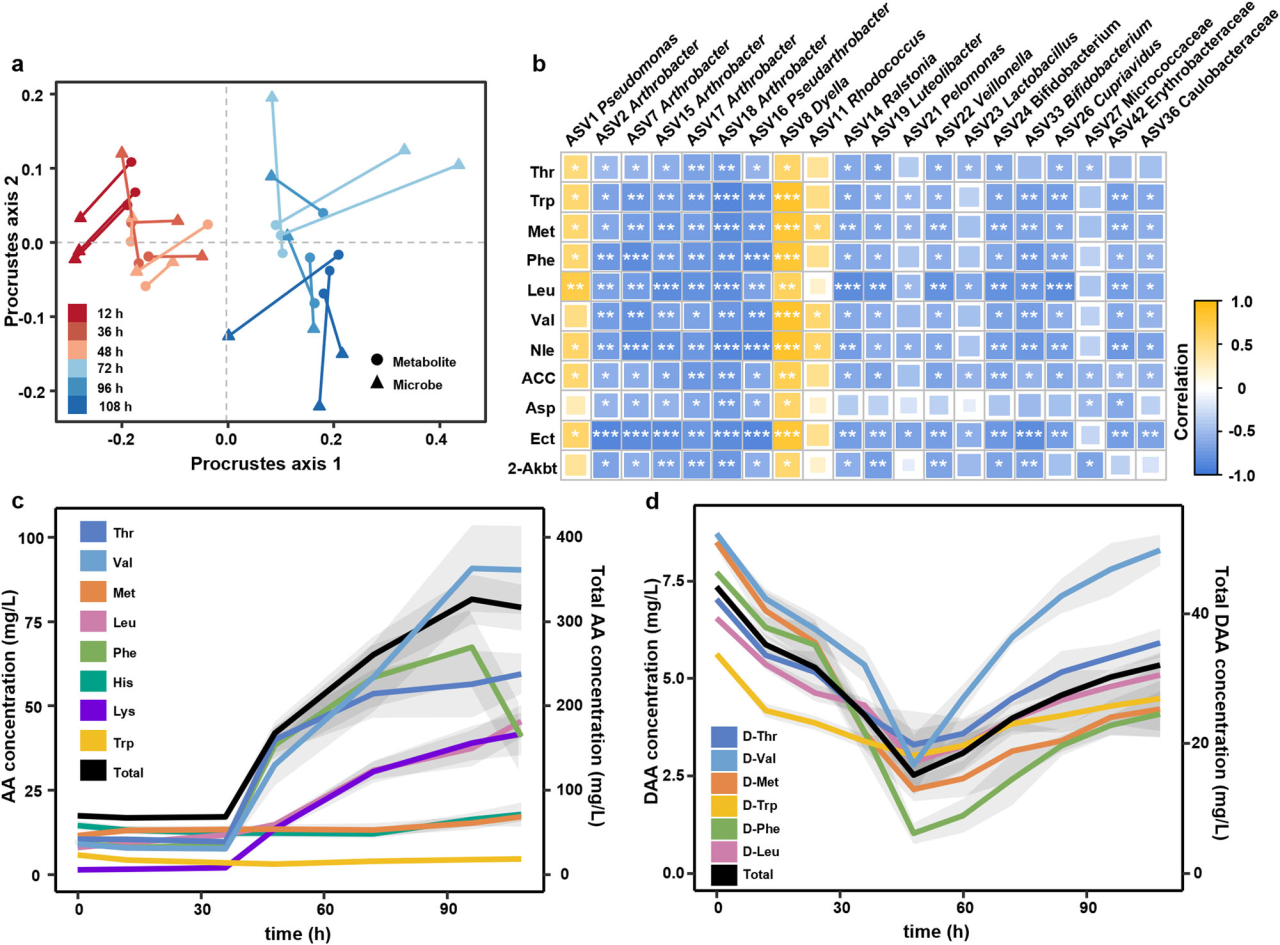
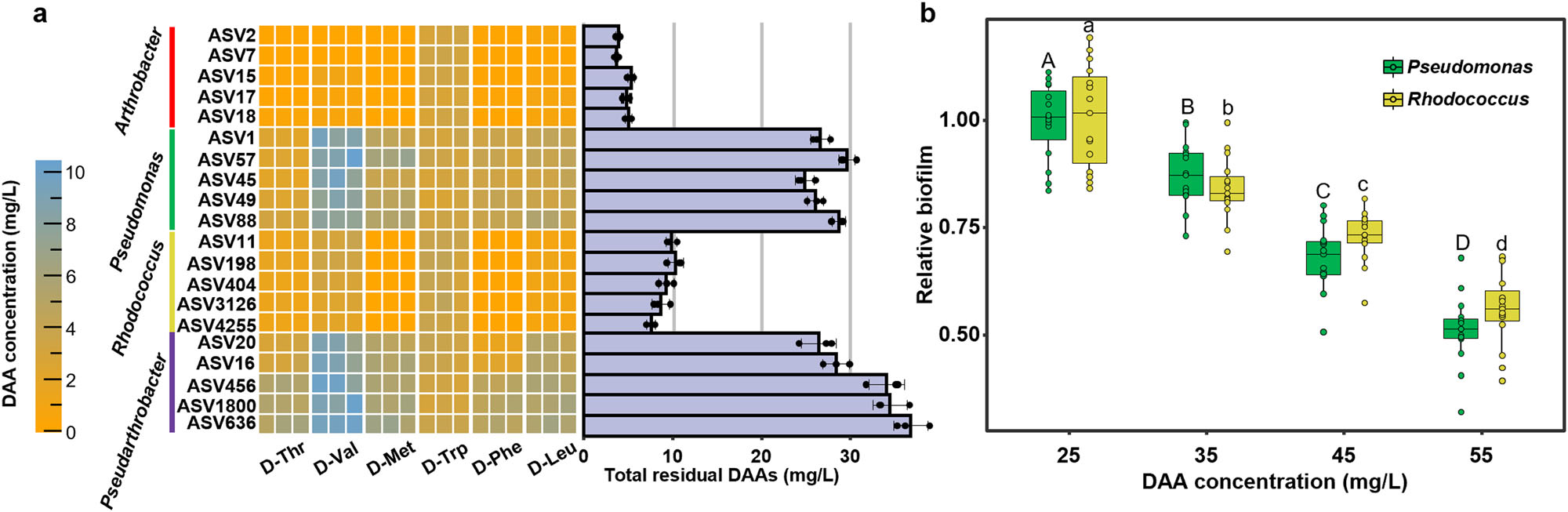
研究結果 1、多孔中生物膜的形成 在微流控裝置中接種從土壤中獲取的復雜微生物群落,然后加入ISEM培養基。生物膜的發育始于微柱陣列上形成的小微生物菌落。生長72 h后,生物膜開始覆蓋微柱表面,并向孔隙空間延伸,最終堵塞多孔載體的通道(圖1b)。72h后生物膜粗糙度顯著增加(圖1c)。粗糙度的增加,通常表明成熟生物膜的形成,擴大了液-生物膜界面,允許營養物質有效地向生物膜傳遞。qPCR定量結果顯示浮游細胞和生物膜細胞在微流控室中的生長曲線都遵循logistic生長模式,在孵育結束時達到平臺期(圖1d)。除前24 h外,生物膜細胞數量均明顯高于浮游細胞數量。 圖1 | 生物膜形成過程。(a)模擬多孔環境的微流體裝置示意圖。微生物群落組成通過16S rRNA基因擴增子測序獲取。流出物進行外代謝組學分析;(b)多孔環境中生物膜結構的發展。生物膜細胞用SYTO 9染色(綠色)。比例尺長度代表50μm。實驗在四個獨立的微流控芯片上重復,結果相似;(c)生物膜厚度和粗糙度的動態變化(n = 4個芯片× 15粒)。生物膜粗糙度計算為單個顆粒表面生物膜厚度的標準差。數據以平均值±標準差表示;(d)采用qPCR法測定微流控室浮游生物和生物膜細胞的數量(n = 4個芯片)。實線顯示浮游細胞的比例隨著生物膜發育的增加而減少。數據以平均值±標準差表示。 2、多孔載體上微生物的群落演替 為了研究生物膜發育過程中的群落演替,采用16S rRNA基因擴增子測序技術對微流控芯片內的總微生物群落動態進行了監測。隨著生物膜形成,同一培養時間下總微生物群落的Bray-Curtis差異減小(圖2a)。在初始階段,群落多樣性和豐富度明顯下降。在成熟生物膜發育(>72 h)后,群落接近穩定狀態。ASV1(Pseudomonas)和ASV2(Arthrobacter)是整個孵育階段最豐富的兩種ASV,占總reads的76.4%(圖2b)。這兩種ASV的相對豐度在早期(<48 h)同時增加,但在生物膜成熟后發生變化(圖2b)。微生物群落演替是由同質選擇驅動的,隨著生物膜的發育,其相對重要性從39.5%增加到90.0%以上(圖2c)。在屬水平上,Pseudomonas對群落演替的貢獻最大,其次是Arthrobacter,在早期(≤48 h)的演替貢獻率超過15%(圖2d)。這些結果表明,Pseudomonas和Arthrobacter是形成群落結構的關鍵類群。 圖2 | 生物膜形成過程中的空間生態位劃分。(a)微生物群落Bray-Curtis差異值隨著培養時間下降(two-sided Pearson r = ?0.754, p = 4.69×10?11),實線表示線性回歸,灰色陰影表示95%置信區間;(b)前20的ASV在總微生物群落中的相對豐度(占總reads數的86.3%)。線的顏色對應于右邊圖例中的不同ASV。實線表示平均值,陰影表示三個生物重復的標準差;(c)不同生態過程在生物膜群落組裝中的相對重要性,包括同質選擇(HoS)、異質選擇(HeS)、同質擴散(HD)、擴散(DL)和漂變(DR)。數據以確定性過程和隨機性過程相對重要性的平均值±標準差表示。不同字母表示差異顯著(p < 0.05,單因素方差分析);(d)不同屬對群落演替的相對貢獻。列的顏色是基于分類(右側的分類圖例);e微流控室生物膜的FISH圖像。該生物膜同時與Arthrobacter (ART179-Alexa546,紅色)和Pseudomonas(PSE227-Alexa488,綠色)探針雜交。生物膜細胞用DAPI染色(藍色)。根據綠色和紅色熒光細胞的面積(n = 4個芯片× 15個微柱)計算Pseudomonas和Arthrobacter在生物膜中的比例。數據以平均值±標準差表示。比例尺長度代表50μm。 3、生物膜形成早期的空間分離 屬特異性探針在微流控芯片上進行FISH原位雜交分析結果顯示,12 h時,檢測到少量的Pseudomonas和Arthrobacter,并且大多數仍留在浮游群落中(圖2e)。值得注意的是,在36 h時,Pseudomonas在生物膜中的比例增加到70.7±14.2%。在此期間,其在浮游群落中的相對豐度同時從68.4±5.2%下降到18.5±8.6%(圖2e)。基于qPCR和擴增子測序分析(圖1d, 2b),12 h時,微流控室中有19.5±12.7%的Pseudomonas棲息在生物膜上,36 h時,這一比例進一步上升至97.3±10.0%。固定化Pseudomonas細胞比例的增加表明,Pseudomonas在生物膜發育早期經歷了從浮游到生物膜形成的轉變。相反,在生長36 h后生物膜中仍然很少觀察到Arthrobacter,而其在浮游群落中的比例從15.8±2.3%上升到64.5±10.4%,成為浮游群落中最常見的分類單元(圖2e)。自由生活的Arthrobacter和形成生物膜的Pseudomonas分別占據流體和微柱表面環境。在后期,觀察到密集排列的Pseudomonas生物膜覆蓋微柱顆粒和孔隙空間。96 h時Pseudomonas在生物膜中的比例增加到84.5±12.3%(圖2e)。浮游生物群落主要由從生物膜群落中分散出來的細菌組成,主要由Pseudomonas、Rhodococcus和Lysinibacillus組成。鑒于相對豐度同時增加(圖2b),研究者假設Pseudomonas和Arthrobacter之間潛在的積極相互作用誘導了空間分離。 圖3 | ISEM培養基中個體生長性能與兩兩相互作用。(a)ISEM培養基中Arthrobacter菌株與其他3屬分離株的個體生長和兩兩共培養相互作用。個體浮游生物的生長用OD600來衡量。結晶紫染色后用OD590定量生物膜產率。根據共培養中各成員單株生物膜產量的最小值(Ymin)、平均值(Yave)、最大值(Ymax)和總和(Ysum)以及共培養生物膜產量(Yco),兩兩相互作用可分為正相互作用(Yco > Ysum)、強負相互作用(Yco < Ymin)或弱負相互作用(Ysum≥Yco≥Ymin);(b) ASV1 P. fluorescens與ASV2 A. ramosus共培養中生物膜形成相關基因的關鍵差異表達。括號中的數字表示具有相同功能的差異表達基因的數量;浮游的Arthrobacter(c)與形成生物膜的分離菌株(d)在條件培養基中的相互作用。根據條件培養基(Yc)和非條件培養基(Yu)中生物膜或浮游生物的生長情況,相互作用可分為正相互作用(Yc≥Yu)、弱負相互作用(1 > Yc/Yu≥0.5)和強負相互作用(Yc/ Yu < 0.5)。 4、個體生長和成對相互作用表明Arthrobacter誘導生物膜的形成 研究者對從微流控芯片中分離的細菌菌株的個體生長性能和成對共培養下的相互作用進行了分析,以弄清空間分離的潛在機制(圖3a)。從4個屬中篩選出20個豐度最高的分離株(圖3a)。盡管所有分離株在ISEM培養基中都表現出明顯的浮游生長,但Arthrobacter菌株表現出最小的生物膜形成能力(圖3a)。這表明,在生物膜生長的后期,Arthrobacter的消失是由于其在生物膜形成方面的能力匱乏,以及在ISEM持續沖洗的情況下無法永久定植。大多數Arthrobacter菌株與形成生物膜的Pseudomonas和Rhodococcus之間的屬間相互作用是正向的(圖3a)。 對其中兩個共培養組合進行基因組學和轉錄組學分析,以揭示種間相互作用中的轉錄應答。與ASV2(A. ramosus)共培養可誘導ASV1(P. fluorescens)和ASV11(R. erythropolis)部分基因/代謝途徑上調、ASV1的生物膜形成相關基因高表達(圖3b)等。此外,ASV1負責合成環境合作產物的基因,如鐵載體和電子穿梭體(核黃素(RF)、黃素單核苷酸(FMN)和黃素腺嘌呤二核苷酸(FAD))的基因顯著上調(圖3b)。 通過在條件培養基(新鮮ISEM和培養Arthrobacter 48h后的ISME培養基上清液以1:1的比例混合制備)中培養形成生物膜的分離株(圖3c),進一步驗證自由生活的Arthrobacter的外代謝物可以通過促進生物膜的形成來誘導空間分離,同時生物膜微生物通過公共代謝產物的生產來提高Arthrobacter在浮游群落中的適應性。 圖4 | 群落組裝期間的外代謝產物池動態。(a)總微生物群組成非度量多維尺度分析(NMDS)圖與代謝組NMDS圖的Procrustes旋轉(Procrustes correlation = 0.72, p = 0.001)。(b)ASV(在微流控芯片整體微生物群落中相對豐度>0.1%和氨基酸之間的相關性)。只有滿足要求的結果展示( Spearman’s rank correlation coefficients |r| ≥ 0.5, ***p ≤ 0.001, **p ≤ 0.01, *p ≤ 0.05)。(c)總氨基酸在上清液中的累積(n=3個芯片)。(d) DAA在生物膜形成過程中呈現“v”型動態(n=3個芯片)。陰影區域表示三個生物學重復的標準差。 5、d -氨基酸(DAA)的消耗會引發空間分離 通過非靶向代謝組學分析微流控芯片流出物中細胞外代謝物的動態,以解析胞外代謝物如何驅動的空間分離。微流控芯片中的外代謝產物與總群落組成之間存在強烈且高度顯著的相關性(圖4a),Arthrobacter和Pseudomonas在氨基酸代謝中起著不同的作用(圖4b)。同時,D型氨基酸(DAAs)的消耗與Arthrobacter的生長一致,表明Arthrobacter在DAA消耗中可能起作用(圖4d)。由于已知DAA通過抑制初始附著、EPS產生和群體感應來抑制生物膜的形成,研究者認為DAA的消耗是觸發空間分離的核心代謝特征。 6、Arthrobacter通過DAA水解誘導生物膜形成 分離菌株在ISEM中培養,考察其對DAA的去除能力。ISEM初始DAA濃度為44.1 mg/L。Arthrobacter菌株表現出較強的DAA去除能力(圖5a)、隨著DAA濃度的降低,條件培養基中Pseudomonas和Rhodococcus的生物膜形成比在ISEM中增強(圖3c, 5b)等結果有力地支持Arthrobacter通過去除生物膜抑制劑DAA來誘導空間分離這一假設。 圖5 | DAAs對生物膜形成的抑制作用。(a)每個分離株生長48 h后ISEM中的DAAs殘留量(n = 3個生物學獨立重復)。條形圖顯示了培養中的總殘留DAA。數據以平均值±標準差表示。(b)不同DAAs水平的條件培養基(每屬5株× 3個重復)的相對生物膜形成情況。每個分離株的生物膜生物量(用OD590表示)與在含25 mg/L d -氨基酸的條件培養基中形成的生物膜生物量歸一化。不同字母表示差異顯著(p < 0.05,one-way ANOVA)。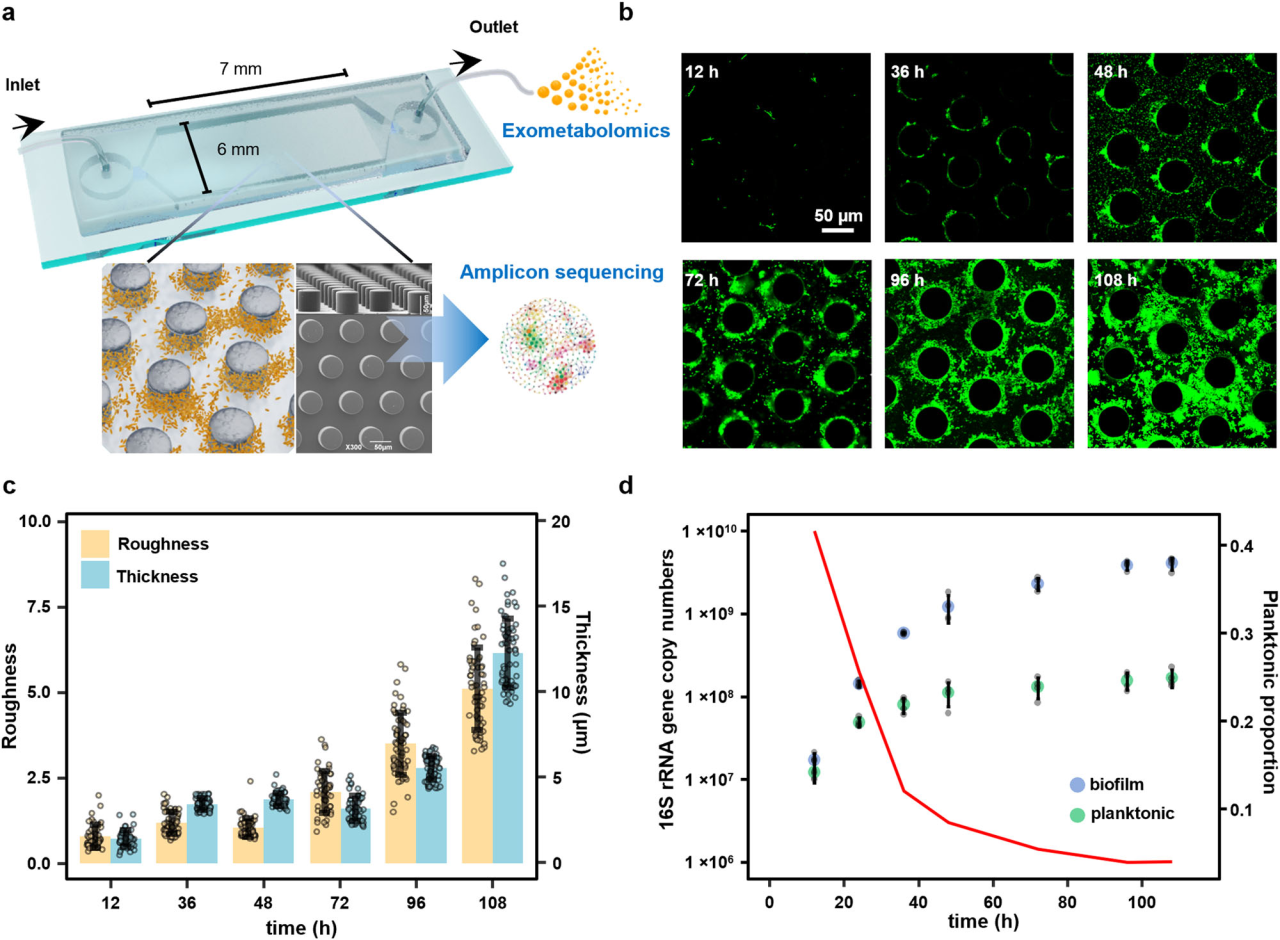
研究結論 孔隙環境中浮游微生物與生物膜之間的相互作用會促使微生物群落空間分化。本研究證明了生物膜形成能力較弱的Arthrobacter通過去除生物膜形成抑制分子D型氨基酸,促進Pseudomonas在固相表面定植形成生物膜。同時,生物膜在形成過程中分泌的公共代謝產物,則會提高Arthrobacter在流體環境中的生長與繁殖。這種互惠型合作關系促使Arthrobacter與Pseudomonas能夠在群落定植初期分別快速占據流體環境和固相表面,進而誘導孔隙環境中微生物群落的空間組裝與分布。上述研究結果為土壤和沉積物等孔隙環境中微生物群落的組裝和演替提供了新的見解。
文章索引 Wu, Y., Fu, C., Peacock, C.L. et al. Cooperative microbial interactions drive spatial segregation in porous environments. Nat Commun 14, 4226 (2023). https://doi.org/10.1038/s41467-023-39991-4