
2023-06-27

《International Journal of Biological Sciences》
影響因子:10.75
文章題目:Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages 技術手段:IP-MS,WB、qPCR 上海交通大學醫學院附屬瑞金醫院近期在《International Journal of Biological Sciences》上發表了PKM2乳酸化修飾抑制促炎巨噬細胞的炎癥代謝適應的研究成果。
NO.1 研究背景 巨噬細胞是高度可塑性的免疫細胞,可以呈現出從穩態、促炎、促纖維化到修復表型等。在傷口自然愈合過程中,巨噬細胞最初表現為對殺滅病原微生物至關重要的促炎表型,此后不久,巨噬細胞向修復表型轉變,限制炎癥反應,并利于組織再生。近年來,炎癥-修復譜調節巨噬細胞表型在創面愈合調控中的重要性日漸清晰。既往工作表明,阻止巨噬細胞從促炎表型向修復表型轉化顯著延遲傷口愈合。然而,決定表型轉變的參與分子和調控機制尚未完全闡明。 代謝適應是巨噬細胞表型轉變的前提和重要標志。促炎性巨噬細胞表現出Warburg效應,意味著糖酵解增加和三羧酸(TCA)循環減弱;而修復性巨噬細胞的能量主要來源于TCA循環、脂肪酸氧化和氧化磷酸化。免疫代謝研究表明,巨噬細胞代謝譜決定其活化狀態和功能,抑制糖酵解可刺激腹腔巨噬細胞從促炎表型轉變為修復表型,調控巨噬細胞的代謝譜對調節表型至關重要。
NO.2
技術路線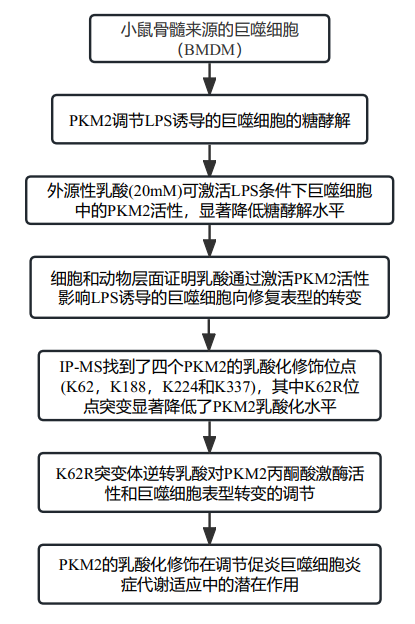
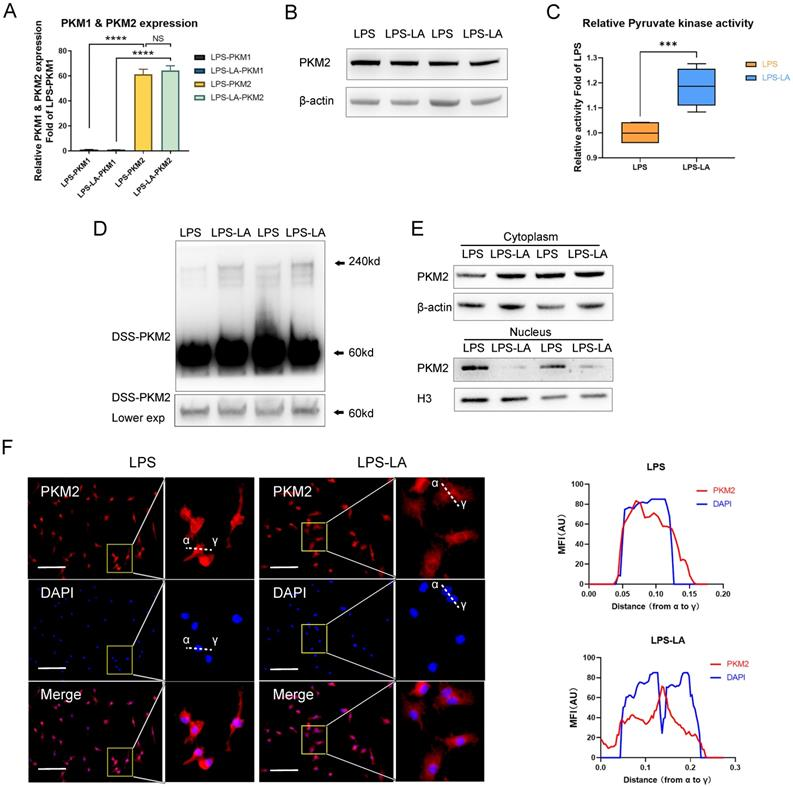
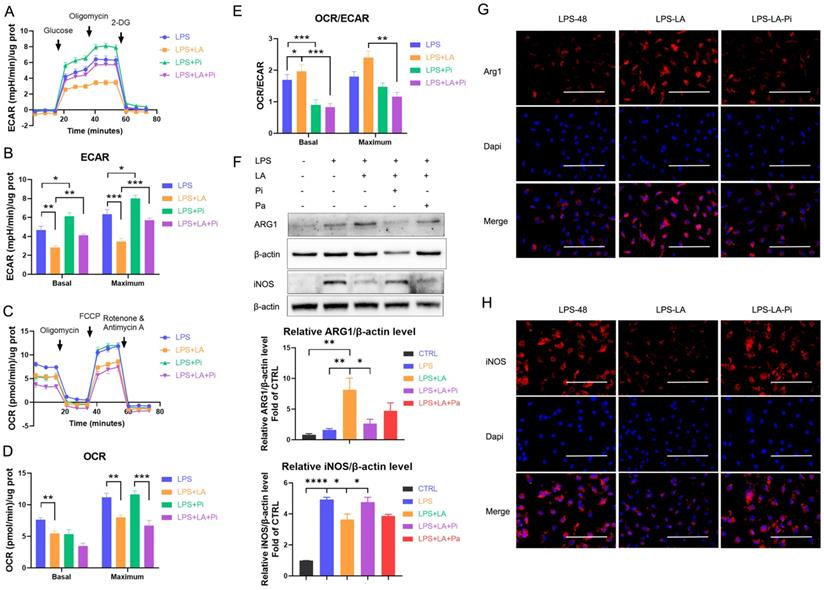
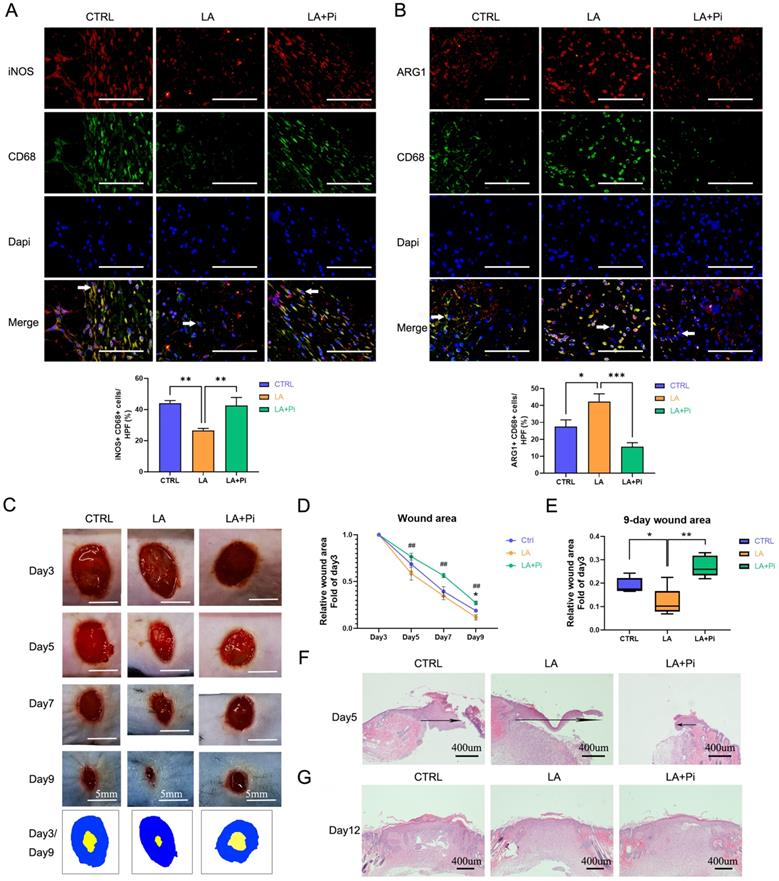
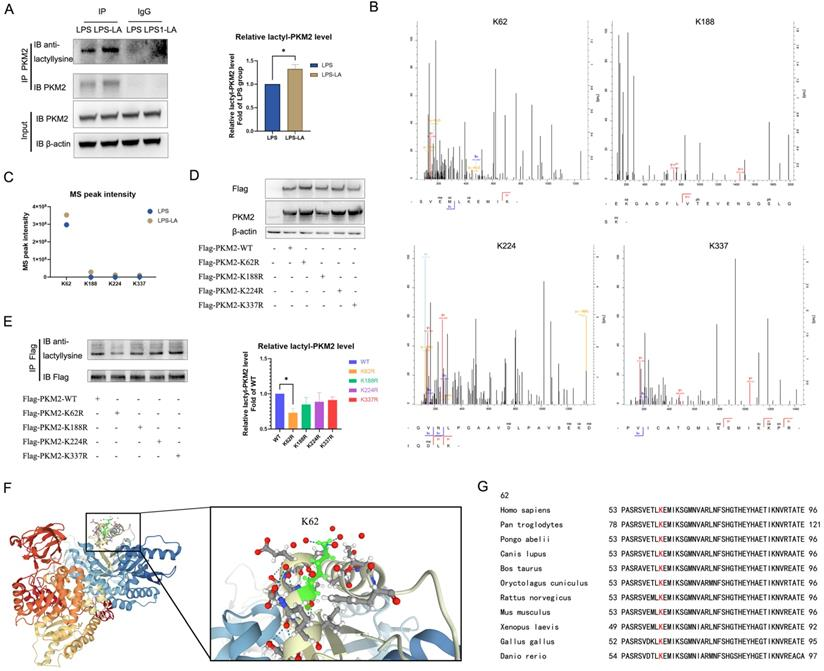
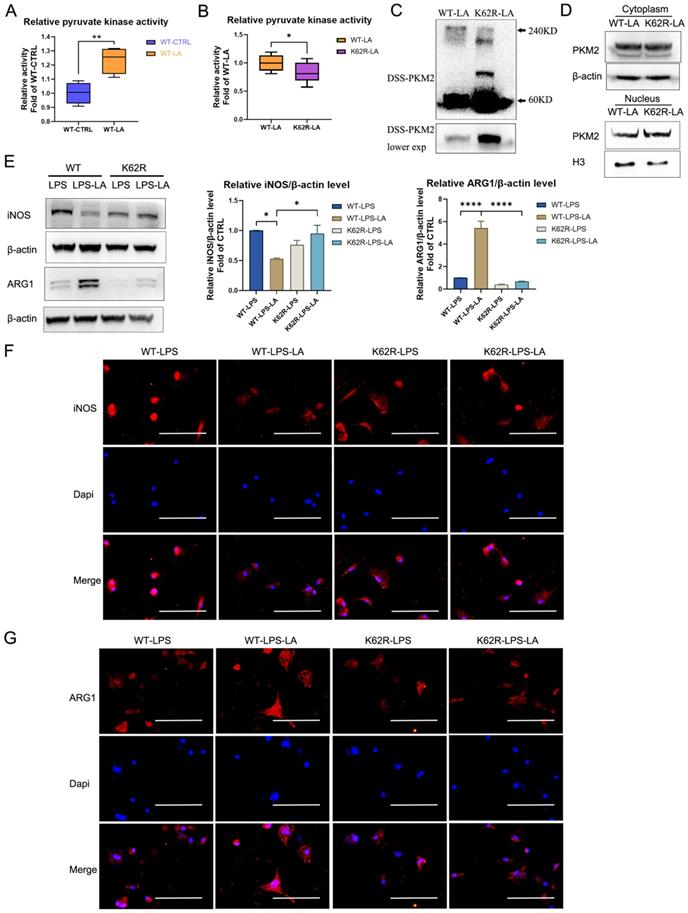
NO.3 研究結果 PKM2調節LPS誘導的巨噬細胞的糖酵解 免疫細胞優先表達兩種丙酮酸激酶異構體PKM1和PKM2,na?ve BMDM細胞中PKM2 mRNA的表達明顯高于PKM1的表達(圖1A)。100 ng/ml LPS孵育24小時后,PKM2的mRNA表達和蛋白水平顯著增加,也顯著高于25 ng/ml IL-4誘導的巨噬細胞(圖1B, C)。BMDM細胞裂解物的DSS交聯表明,LPS誘導的巨噬細胞中四聚體形式的PKM2 (240KD)水平顯著低于na?ve和IL-4誘導的巨噬細胞(圖1E)。 如圖1F所示,LPS導致細胞核中PKM2的表達增加。通過免疫熒光觀察到LPS誘導的巨噬細胞胞核內PKM2的水平明顯高于na?ve和IL -4誘導的巨噬細胞(圖1G)。這些結果表明PKM2在LPS誘導的巨噬細胞中過表達,但比在na?ve和IL -4誘導的巨噬細胞中更無活性。PKM2酶抑制劑引起LPS孵育的巨噬細胞中糖酵解速率的顯著增加(圖1H, I),但未導致OCR的變化(圖1J)。在LPS誘導的BMDM細胞模型中,PKM2酶抑制劑增加了糖酵解過程,這表明降低PKM2丙酮酸激酶活性可以增強Warburg效應,進而促進促炎巨噬細胞的炎癥代謝適應。 圖1. PKM2調節脂多糖誘導的巨噬細胞的糖酵解 乳酸在LPS誘導的巨噬細胞中激活PKM2 PKM2調控糖酵解和乳酸生成;然而,乳酸是否調節PKM2仍不清楚。因此,首先檢測了乳酸對BMDM細胞中PKM2 mRNA表達和蛋白水平的影響。結果表明,外源性乳酸(20mM)的干預既沒有改變LPS誘導的巨噬細胞中PKM2的mRNA表達(圖2A),也沒有改變PKM2的蛋白水平(圖2B)。乳酸顯著促進LPS誘導的巨噬細胞的丙酮酸激酶活性(圖2C)。BMDM細胞裂解物的DSS交聯表明,LPS-LA組的PKM2四聚體形式(240KD)水平顯著高于LPS組(圖2D)。免疫熒光結果顯示,與LPS組相比,LPS-LA組細胞核中PKM2的表達明顯降低(圖2E, F)。這些結果表明,乳酸在LPS誘導的巨噬細胞中激活了PKM2。 圖2. 乳酸激活脂多糖誘導的巨噬細胞中的PKM2 乳酸抑制糖酵解,并通過激活PKM2促進LPS誘導巨噬細胞向修復表型的轉變 通過檢測了乳酸對LPS誘導的巨噬細胞ECAR和OCR水平的影響,結果顯示乳酸顯著降低LPS誘導的巨噬細胞的ECAR和OCR水平,但增加了OCR/ECAR比值,且外源性乳糖逆轉了PKM2酶抑制劑對ECAR的增加和對OCR/ECAR比值的減少(圖3A-E)。這些結果表明乳酸可能通過激活PKM2而損害LPS誘導的巨噬細胞的炎癥代謝適應。 作者分析了乳酸是否通過激活PKM2促進LPS誘導的巨噬細胞向修復表型的轉變。在LPS誘導的BMDM細胞中,乳酸可升高ARG1水平以及降低iNOS水平,然而,PKM2酶抑制劑逆轉了上述結果(圖3F-H)。這些結果支持乳酸通過激活PKM2部分促進LPS誘導的巨噬細胞向修復表型轉化的理論。 圖3. 乳酸抑制糖酵解并通過激活PKM2促進脂多糖誘導的巨噬細胞向修復表型的轉變 乳酸促進傷口巨噬細胞向修復表型轉變,并通過激活PKM2加速小鼠傷口愈合 作者使用小鼠構建了皮膚傷口模型,在傷口造模后第3天和第5天給予外源性乳酸鹽(20mM)局部處理。造模后第5天,乳酸干預組創面組織中促炎巨噬細胞(iNOS+ CD68+陽性細胞)明顯降低,而修復性巨噬細胞(ARG1+ CD68+陽性細胞)水平高于對照組;然而,PKM2酶抑制劑又使促炎巨噬細胞增多,修復性巨噬細胞(ARG1+ CD68+陽性細胞)減少(圖4A-B)。乳酸促進了傷口愈合,但PKM2酶抑制劑阻礙了乳酸的作用(圖4C-D)。 結果顯示乳酸干預組第9天創面面積明顯小于對照組,而PKM2酶抑制劑減弱了乳酸對創面愈合的促進作用(圖4E)。此外,損傷后第5天乳酸促進了皮膚上皮細胞的遷移能力,而PKM2酶抑制劑阻礙了乳酸對皮膚上皮細胞遷移的作用(圖4F),但傷后第12天時,三組皮膚質量無明顯差異(圖4G),這表明乳酸干預并沒有降低傷口的愈合質量。綜上所述,在小鼠中,局部給藥外源性乳酸通過促進PKM2促進傷口巨噬細胞從促炎表型向修復表型的轉變以及加速傷口愈合。 圖4. 乳酸通過激活PKM2促進小鼠創面巨噬細胞向修復表型轉化,加速創面愈合 乳酸促進PKM2的K62乳酸化 為了進一步探究乳酸激活PKM2的機制,作者在LPS誘導的BMDM細胞模型中,用PKM2抗體進行IP實驗,并使用乳酸化泛抗體檢測PKM2的乳酸化水平,發現乳酸處理上調了PKM2的乳酸化水平(圖5A)。圖5B、C結果顯示作者通過IP-質譜分析找到了四個PKM2的乳酸化修飾位點 (K62,K188,K224和K337),其中K62R位點突變顯著降低了PKM2乳酸化水平,其余3個位點突變對乳酸化水平無顯著改變,這表明K62位點是PKM2的主要乳酸化位點(圖5E)。PKM2的三級結構表明,K62位于PKM2蛋白的A結構域(圖5F),并且與關鍵活性位點S362相鄰。因此,乳酸通過介導PKM2 K62位點的乳酸化水平增加其丙酮酸激酶活性,進而促進巨噬細胞向修復表型的轉變。 圖5乳酸促進PKM2的K62乳酸化 K62R突變體逆轉乳酸對PKM2丙酮酸激酶活性和巨噬細胞表型轉變的調節 通過實驗進一步評估了K62位點乳酸化對PKM2功能的調節作用。如圖6A所示,乳酸顯著促進了WT型PKM2過表達293T細胞中PKM2酶的活性,而K62R突變顯著抑制了乳酸處理后293T細胞中的PKM2酶活性(圖6B)。乳酸處理的293T細胞裂解物的DSS交聯后發現K62R-乳酸組PKM2四聚體形態水平明顯低于乳酸組(圖6C)。此外,K62R-乳酸組細胞核內PKM2水平顯著高于乳酸組(圖6D)。這些結果證實了K62位點對PKM2的功能有顯著影響,并證明乳酸通過K62位點促進PKM2酶活性。 使用慢病毒載體在BMDM細胞中過表達K62R突變或WT PKM2。LPS孵育48 h后,乳酸增加了WT PKM2 BMDM細胞中ARG1水平但降低了iNOS水平,這些作用被過表達K62R-突變減弱(圖6E-G)。以上結果說明乳酸在一定程度上通過PKM2在K62位點的乳酸化來促進LPS誘導的巨噬細胞向修復表型轉變。 圖6 K62R突變體逆轉了乳酸對PKM2丙酮酸激酶活性和巨噬細胞表型轉變的調節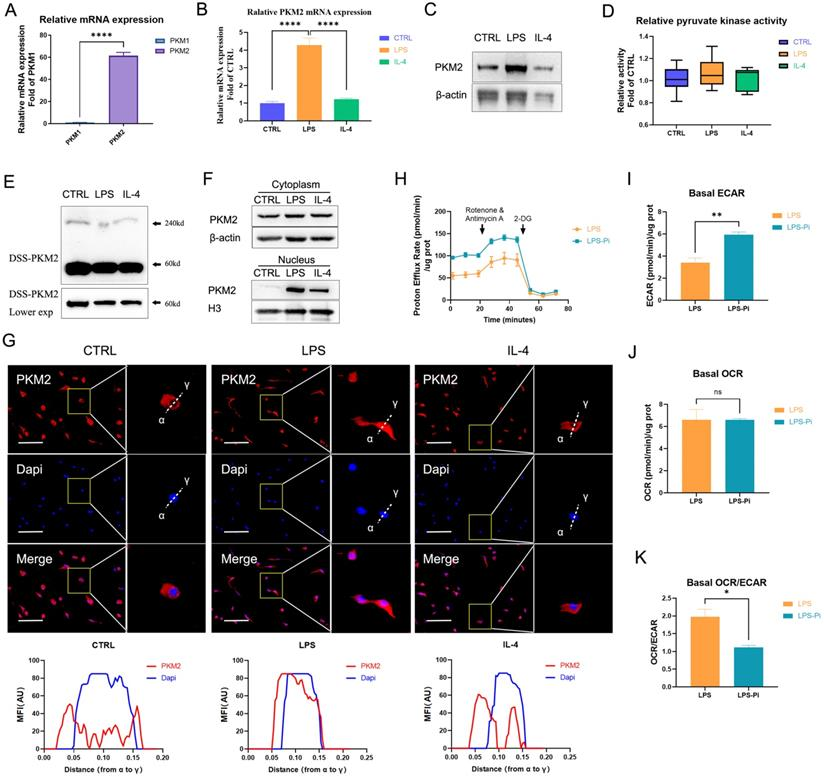
NO.4結 論 PKM2在促炎性巨噬細胞代謝適應和表型轉化中具有重要調控作用,并首次發現PKM2存在乳酸化修飾、第62位賴氨酸位點為其主要的乳酸化修飾位點,乳酸化修飾可增強PKM2的丙酮酸激酶活性、抑制M1巨噬細胞糖酵解、促進促炎表型巨噬細胞向修復表型轉變。該研究闡明了PKM2的乳酸化修飾在調節促炎巨噬細胞炎癥代謝適應中的潛在作用。
本研究中shotgun修飾鑒定及部分分析工作由上海派森諾生物科技股份有限公司完成。
參考文獻:Wang J, Yang P, Yu T, Gao M, Liu D, Zhang J, Lu C, Chen X, Zhang X, Liu Y. Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages. Int J Biol Sci 2022; 18(16):6210-6225. doi:10.7150/ijbs.75434.