
2023-02-21

《Pharmacological Research》
影響因子:10.334
文章題目:Functional metabolomics revealed the dual-activation of cAMP-AMP axis is a novel therapeutic target of pancreatic cancer 技術手段:RNA-seq,LC-MS/MS 上海交通大學近期在《Pharmacological Research》上發表了功能代謝組學揭示了cAMP-AMP軸的雙重激活是胰腺癌新治療靶點的研究成果。
研究背景 胰腺癌癥(Pancreatic Cancer)是消化道常見惡性腫瘤之一,因其極高的侵襲性和死亡率而引起廣泛關注,胰腺癌的臨床治療局限于隱匿的早期癥狀和復雜的發病機制,目前對其的治療主要是通過手術切除和吉西他濱藥物治療。由于對胰腺癌的理解還存在不足,現有藥物效率和新藥物發現的較大挑戰是缺乏有效的治療靶點。 吉西他濱具有廣譜抗腫瘤活性,在卵巢癌、乳腺癌、膀胱癌、宮頸癌及腎細胞癌的臨床治療中都具有一定療效。目前急需從系統生物學驅動的功能代謝組學策略發現吉西他濱的新靶點,從而找到治療胰腺癌的新藥物,或者添加輔助藥物實現老藥新用。本研究將為胰腺癌藥物分子的快速篩選評價提供全新靶點。此外,通過制劑優化等手段增強吉西他濱對新靶點的靶向性,將有助于改善其治療胰腺癌的有效性。
技術路線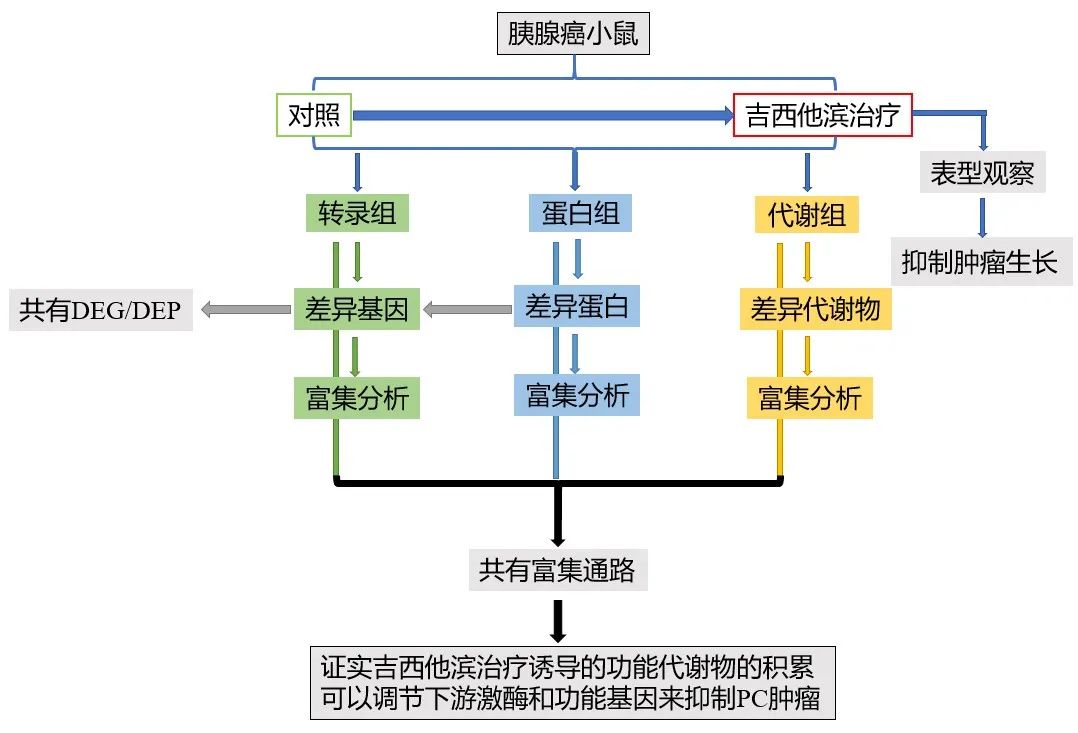
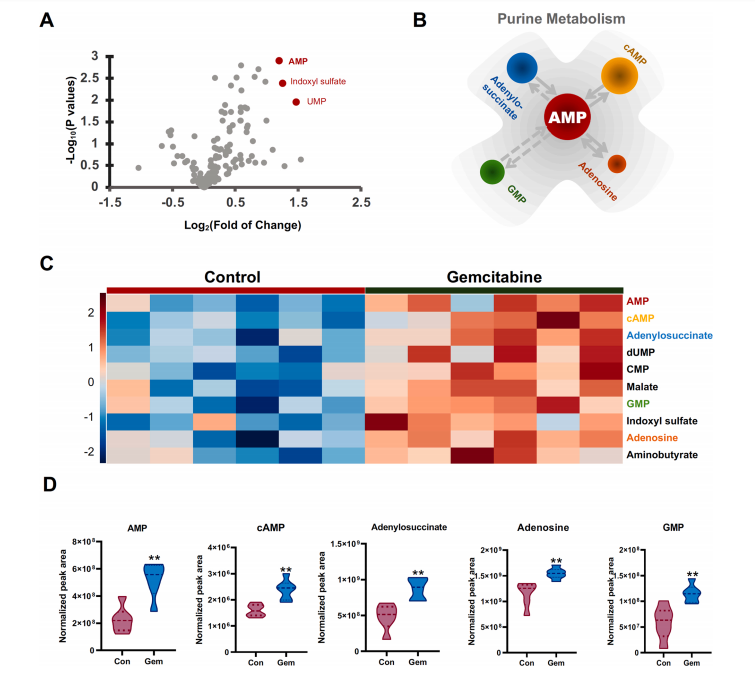
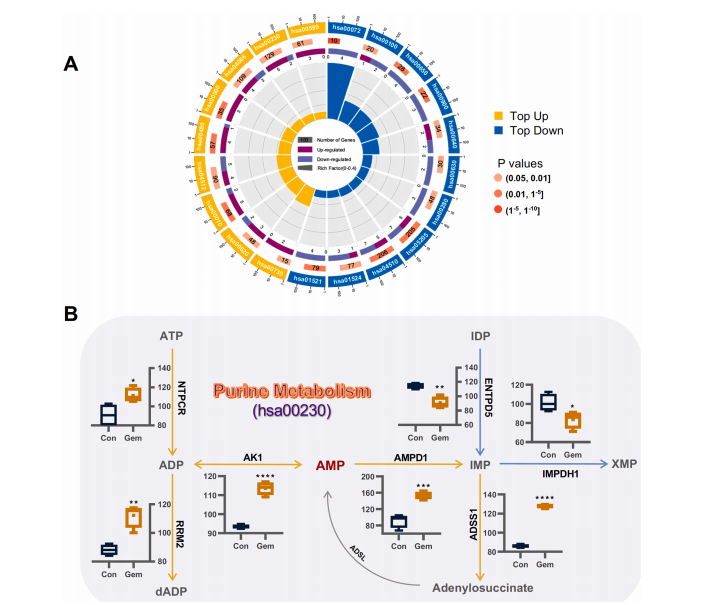
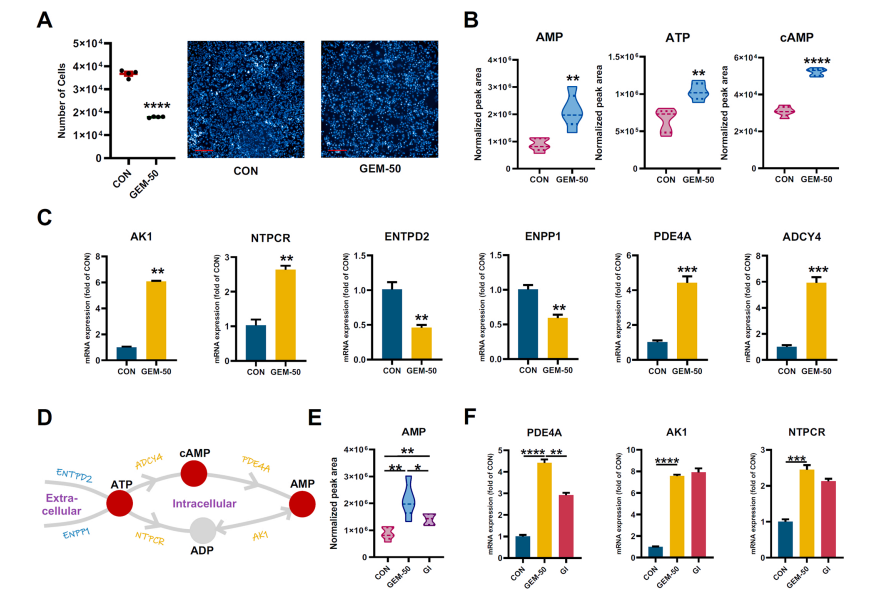
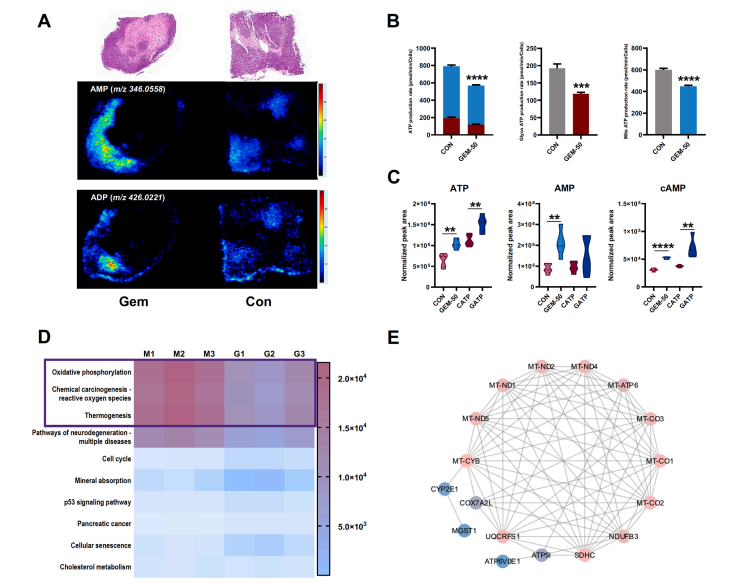
研究結果 AMP是一種新型功能性代謝物,促進吉西他濱對PC腫瘤的抑制作用 吉西他濱治療組皮下腫瘤的重量和體積均明顯減少(圖1B、1C),還驗證了Ki67的標記程度(圖1D),ki67主要用于標記增殖周期中的細胞,該標記率高這主要是由腫瘤生長越快,組織分化能力越差,而對ki67也越敏感,因此證實了吉西他濱抑制腫瘤發生的能力。 將吉西他濱治療前后腫瘤組織中代謝物進行比較,發現154種代謝物發生了變化,并通過火山圖發現吉西他濱顯著上調了AMP、硫酸吲哚酚和UMP的表達水平(圖2A)。此外,通過熱圖識別治療過程中腫瘤組織中變化最顯著的差異代謝物,發現嘌呤代謝相關的AMP、cAMP、腺苷琥珀酸、腺苷和GMP明顯增加(圖2C、2D)。因此,將嘌呤代謝的核心分子AMP確定為功能性代謝物(圖2B),吉西他濱可能將其作為抗PC腫瘤發生的靶點。 圖1. 在裸鼠模型中證實吉西他濱對PC腫瘤的抑制作用 圖2. 靶向代謝組學確定了對吉西他濱治療有反應并受影響最大的功能代謝物 吉西他濱治療PC腫瘤組織中AMP生物合成相關代謝酶明顯上調 基于PC腫瘤組織差異蛋白的KEGG途徑富集分析來解釋吉西他濱的治療作用。其中吉西他濱給藥組嘌呤代謝(has00230)顯著增加(圖3A),許多與AMP生物合成和轉化相關的酶表達水平顯著上調(圖3B),再次證實了AMP在促進吉西他濱對PC的治療效率方面的關鍵作用。 圖3. PC腫瘤組織的蛋白組分析揭示了AMP代謝酶的變化 吉西他濱治療PC時,腫瘤組織中由ATP產生的AMP和cAMP顯著累積 圖4A所示,吉西他濱抑制細胞增殖,而圖4B顯示,細胞內AMP的變化與腫瘤組織代謝組學分析一致。接著確定AMP產生的主要前體,驗證了AK1和NTPCR在Aspc-1細胞中的表達變化。吉西他濱可以通過NTPCR催化ATP生物合成ADP,然后AK1升高調節AMP與ADP之間的雙向催化作用上調,ATP在PC細胞中略有積累(圖4B、4C),進一步定量分析了參與同一生物合成途徑的胞外酶的表達。 隨著PDE4A受到抑制,AMP的水平明顯下降(圖4E),但吉西他濱對AK1和NTPCR的調控幾乎不受IBMX的影響(圖4F),說明cAMP僅促進部分AMP的生物合成,但不影響ATP通過ADP轉化為AMP。由此可見,促進AMP積累的兩條生物合成途徑之間沒有明顯的依賴關系。 圖4. 吉西他濱治療誘導的Aspc-1細胞中功能代謝物和代謝酶的表達變化 質譜成像可視化了吉西他濱靶向的AMP和ADP在PC腫瘤組織中的空間分布 采用AFADESI-MSI技術,可視化功能性代謝物在PC腫瘤組織中的空間分布(圖5A)。可以看到吉西他濱誘導的AMP過度積累在實體瘤的密集區域直觀可見。質譜成像分析揭示了在與AMP重疊的區域觀察到的ADP產量輕微上調。 圖5. 質譜成像可視化PC腫瘤組織中AMP和ADP的相對強度 吉西他濱誘導AMP-cAMP軸雙重激活,靶向GADD45A,調控下游激酶AMPK和PKA信號通路,抑制PC腫瘤 AMP可激活AMPK的磷酸化,誘導腫瘤細胞自噬,而cAMP可通過激活PKA調節多條信號通路(圖6A、6B),誘導腫瘤細胞凋亡和抑制腫瘤啟動。因此,吉西他濱誘導AMP-cAMP軸雙重激活抑制PC腫瘤,主要是通過分別激活下游功能激酶AMPK和PKA誘導腫瘤細胞自噬和凋亡。通過吉西他濱治療期間胰腺癌通路中差異基因的表達,上調了5個與胰腺癌相關的基因,并發現AMP和cAMP均與GADD45A的表達呈正相關(圖6C、D),GADD45A與AMP和cAMP都有較強的相關性(圖6E),因此,GADD45A可能是吉西他濱治療由AMP-cAMP軸雙重激活調節的PC的新靶點。 圖6.吉西他濱誘導AMP-cAMP軸的雙重激活,調節下游激酶和功能基因來抑制PC腫瘤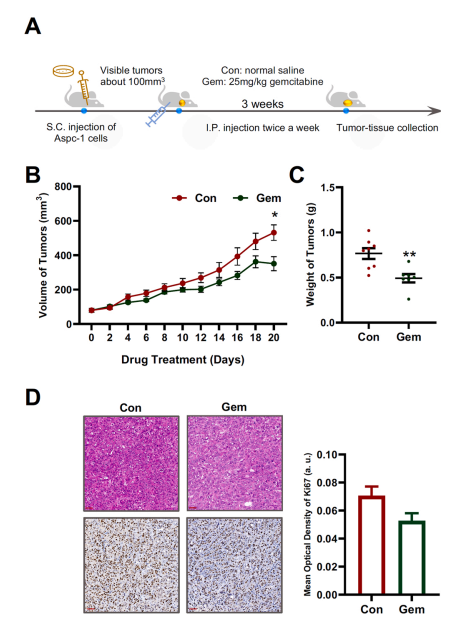
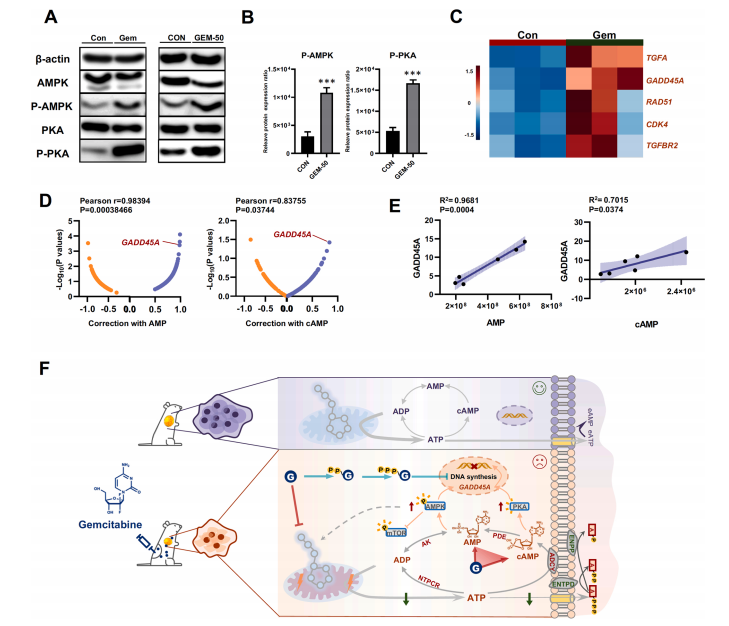
結 論 胰腺癌(PC)是惡性腫瘤之一,具有極高的侵襲性和死亡率,這種情況目前引起了廣泛的耐藥性和治療缺陷。在本研究中,提出了一種新的功能代謝組學策略—時空操作真實代謝組學(STORM),以動態和可視化的模式識別決定性的功能代謝產物,其水平變化與吉西他濱對PC的治療效果有關。結合體內功能代謝物的定量分析和空間可視化表征,發現AMP-cAMP軸是PC的一個新的治療靶點。吉西他濱可誘導cAMP和AMP在腫瘤組織中的雙重累積。相關生物合成酶和基因的定量分析表明,在較低水平的能量環境中,細胞內有兩條獨立的ATP生物合成途徑促進AMP-cAMP軸的雙重激活。然后,吉西他濱誘導AMP和cAMP的雙重累積,可分別激活AMPK和PKA的信號通路,通過上調下游抑瘤因子GADD45A抑制腫瘤生長。綜上所述,吉西他濱誘導AMP-cAMP軸的雙重激活可以有效抑制PC腫瘤生長。
本研究中轉錄組測序及部分分析工作由上海派森諾生物科技股份有限公司完成。
參考文獻:Jingjing Liu, Wanghui Jing, Tianyu Wang, Zhe Hu, Haitao Lu,Functional metabolomics revealed the dual-activation of cAMP-AMP axis is a novel therapeutic target of pancreatic cancer,Pharmacological Research,Volume 187,2023,106554,ISSN 1043-6618.