
2022-06-20

《Cell Metabolism》
影響因子:27.287
近期,派森諾與復旦大學腫瘤醫院以及復旦大學基礎醫學院合作,在Cell集團旗下的知名期刊《Cell Metabolism》(影響因子:27.287),發表重磅研究成果,可喜可賀!
本研究通過對三陰性乳腺癌患者乳腺腫瘤微環境中共生菌以及代謝產物氧化三甲胺(TMAO)進行檢測,發現腫瘤共生菌借助TMAO作用于腫瘤細胞,誘導其焦亡(Pyroptosis),繼而促進免疫細胞浸潤,最終發揮抗腫瘤免疫治療作用。因此,本研究提出了微生物組促進細胞微環境炎性浸潤的一種新機制,為提升特異性免疫應答效率提供了全新的思路!
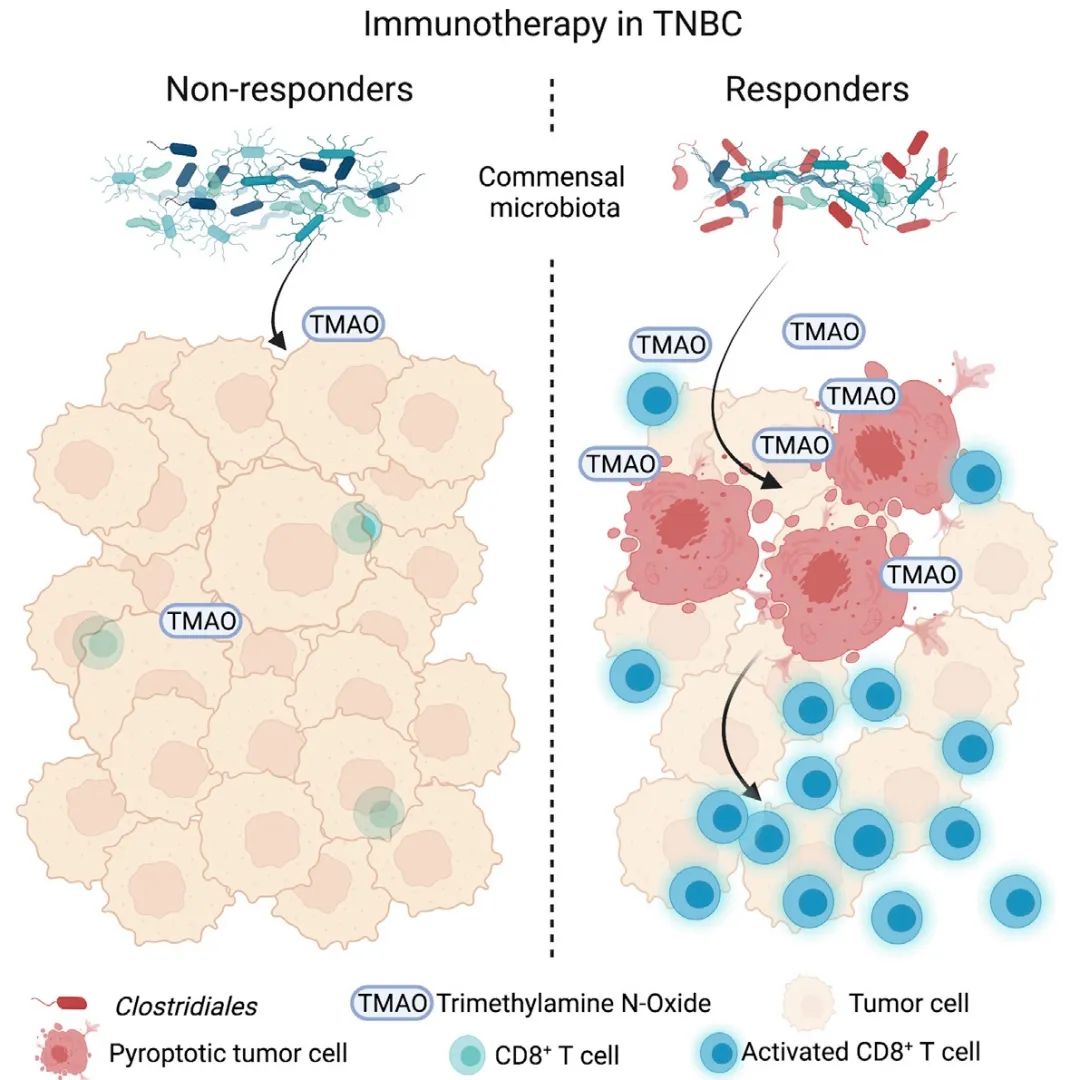
tmao通常被認為是能增加心血管等炎癥相關疾病風險的“有害”代謝產物,但是對于三陰性乳腺癌而言,似乎具有積極的抗腫瘤免疫作用
研究背景
乳腺癌的發病率逐年增高,并成為中國女性發病率最高的惡性腫瘤,是名副其實的“紅顏殺手”。其中,三陰性乳腺癌(TNBC)惡性程度較高,患者生存預后較差,易出現早期復發和轉移,且既往缺乏有效的針對性治療策略,素有最“毒”乳腺癌之稱。
近年來,以PD-1抑制劑為代表的免疫治療成為TNBC頗具前景的治療手段。但即便如此,隨著臨床研究的不斷深入,仍有相當一部分患者難以從免疫治療中獲益。前期研究發現,TNBC中有一類獨特的免疫調節亞型(Immunomodulatory,IM),患者有較為活化的免疫微環境特征,有可能進一步提高精準治療療效,使患者從免疫治療中獲益。
本文與常見研究中報道的抗腫瘤激活劑直接作用于免疫細胞發揮功效不同,本研究從獨特視角出發,發現特殊微生物群落借助代謝產物氧化三甲胺(Trimethylamine N-oxide,TMAO),能夠直接作用于腫瘤細胞,誘導其焦亡,繼而促進免疫細胞浸潤,最終發揮抗腫瘤作用。
研究方法
本研究借助組學分析,檢測了TNBC患者IM亞型和非IM亞型腫瘤的微生物組成。結合代謝數據探討了梭菌相關代謝產物TMAO在IM亞型患者腫瘤中的含量以及與微環境內免疫細胞和免疫因子的相關性。同時,本研究后續結合大量體內、體外實驗以及分子生物學實驗探討了TMAO能夠抑制TNBC腫瘤生長,提高免疫治療療效的機制。最后,通過給小鼠喂食TMAO前體代謝產物膽堿證實補充膽堿攝入可以激活TNBC抗腫瘤免疫,提高免疫治療療效。
研究方法:小鼠糞便16S rRNA基因V3V4區測序+QIIME2分析流程;色譜和質譜檢測分析
測序平臺:Illumina MiSeq高通量測序平臺
研究結果
太長不看版
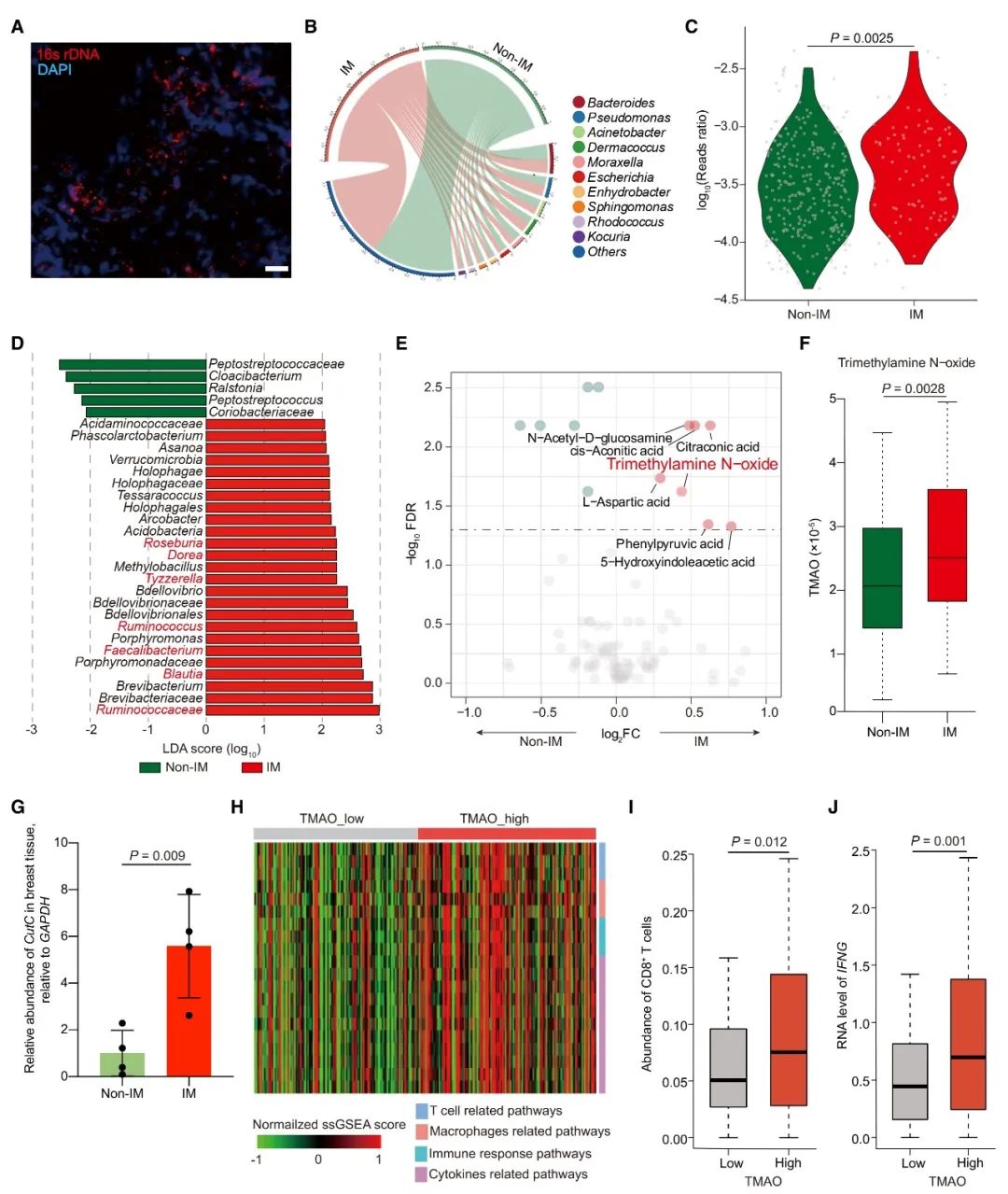
對三陰性乳腺癌(TNBC)隊列(n=360)的多組學分析發現,免疫調節亞型(腫瘤微環境免疫活化)患者的腫瘤組織中,Clostridiales目的多個菌屬及相關代謝產物氧化三甲胺(TMAO)豐度升高,且較高的血漿TMAO水平與較好的免疫治療應答相關;
細胞和TNBC小鼠實驗表明,TMAO通過活化內質網應激激酶PERK來誘導GSDME介導的癌細胞焦亡,從而增強CD8+ T細胞介導的抗腫瘤免疫;
為TNBC小鼠補充膳食膽堿(TMAO前體)能提高腫瘤TMAO水平,增強免疫治療應答。
結果詳解
首先,染色實驗發現,細菌在TNBC患者的腫瘤組織中定殖,并通過微生物組成和差異分析,發現TNBC的IM和非IM亞型之間,在測序數據總讀數和菌群多個分類水平上存在差異。而LEfSe分析的結果表明,在屬水平上,Clostridiales目的Blautia、Ruminococcus、Faecalibacterium、Dorea、Tyzzerella和Roseburia差異顯著。這些微生物能產生TMAO的前體三甲胺(TMA)。進一步研究顯示,TNBC的IM亞型中,厭氧微生物編碼三甲胺裂解酶的cutC基因的相對豐度、TMAO濃度、CD8+ T細胞濃度和IFNG mRNA的表達都顯著高于TNBC的其他亞型。這些結果表明,共生微生物群落的組成在不同亞型的TNBC微環境之間是不同的,并且微生物代謝產物TMAO和能夠調節TNBC免疫微環境的物質之間,存在正相關性。
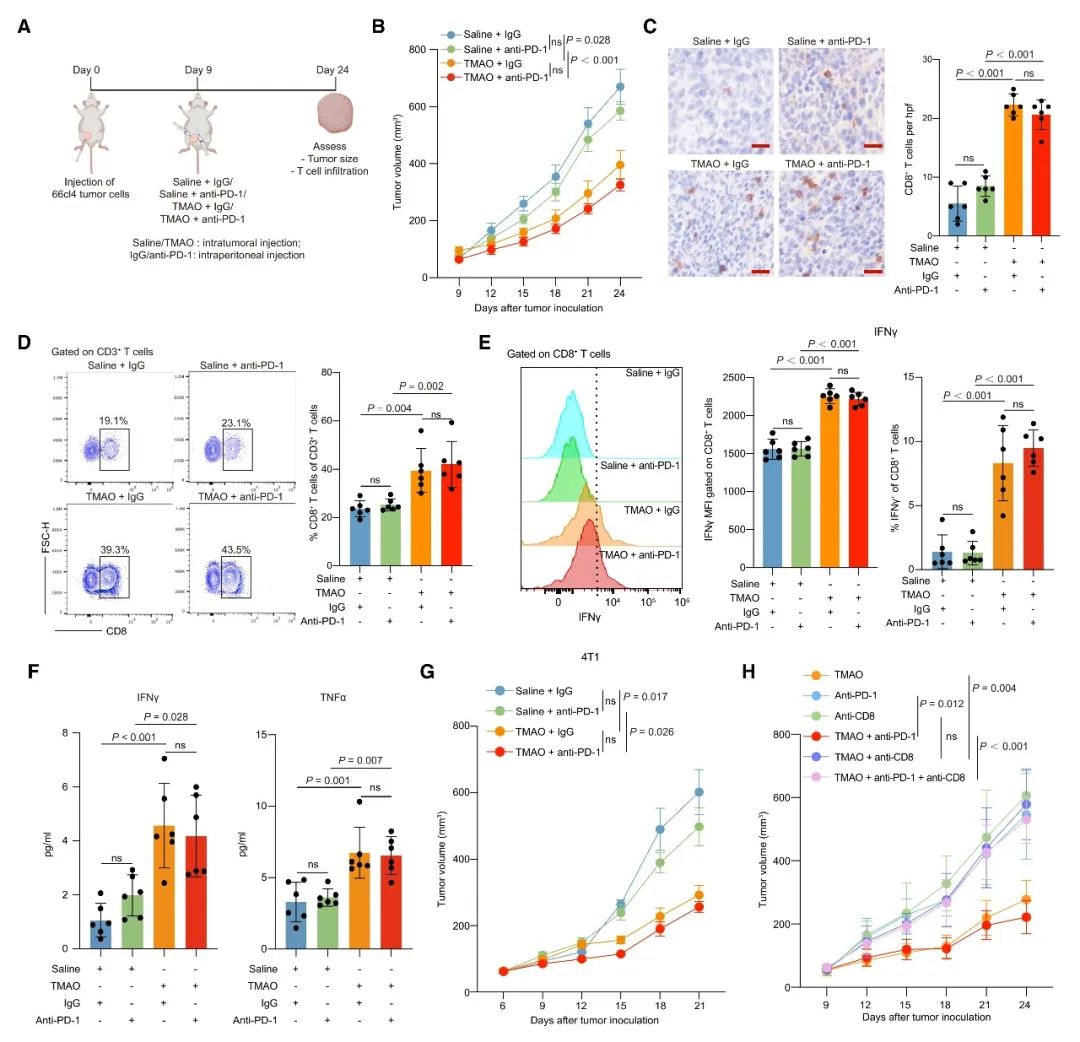
基于小鼠模型的體內研究結果表明,聯合注射TMAO和PD-1抗體,比單獨注射PD-1抗體更顯著地抑制腫瘤生長。此外,腫瘤內注射TMAO顯著促進CD8+ T細胞和M1巨噬細胞的浸潤,并增強CD8+ T細胞的功能以及提高IFN-γ和TNF-α水平。同時,TMAO促進了TNBC小鼠模型的抗腫瘤免疫并增強了PD-1抗體的功效。這說明在腫瘤微環境中升高的TMAO水平,能有效地增強抗腫瘤免疫力并抑制了腫瘤的生長。為了確定TMAO是否在動物體內通過激活CD8+ T細胞調控的抗腫瘤免疫,從而抑制腫瘤生長,使用CD8+ T中和抗體耗盡了小鼠體內的CD8+ T細胞。結果發現,CD8+ T細胞的消耗減弱了TMAO的抗腫瘤作用。這也表明CD8+ T細胞在TMAO介導宿主抗腫瘤免疫的過程中發揮了重要作用。
本研究進一步通過體外細胞實驗,闡述了TMAO激活抗腫瘤免疫的機制。通過細胞形態學觀察以及兩種焦亡相關蛋白caspase和GSDME的檢測,表明TMAO能誘導腫瘤細胞焦亡。為了評估GSDME是否在介導TMAO誘導的焦亡中起主要作用,本研究還同時進行了體內和體外的基因敲低實驗。實驗結果顯示,TMAO增強了CD8+ T細胞的毒性功能,當敲低GSDME時減弱了TMAO誘導的抗腫瘤免疫力。此外,在注射TMAO的腫瘤中檢測到IL-1β和IL-18水平升高,當敲低GSDME時減弱了腫瘤組織中IL-1β和IL-18的分泌。而這兩種炎癥因子在細胞焦亡過程中分泌并激活腫瘤微環境中的抗腫瘤免疫。這些結果都表明了TMAO可通過誘導GSDME介導的細胞焦亡來激活TNBC的抗腫瘤免疫。
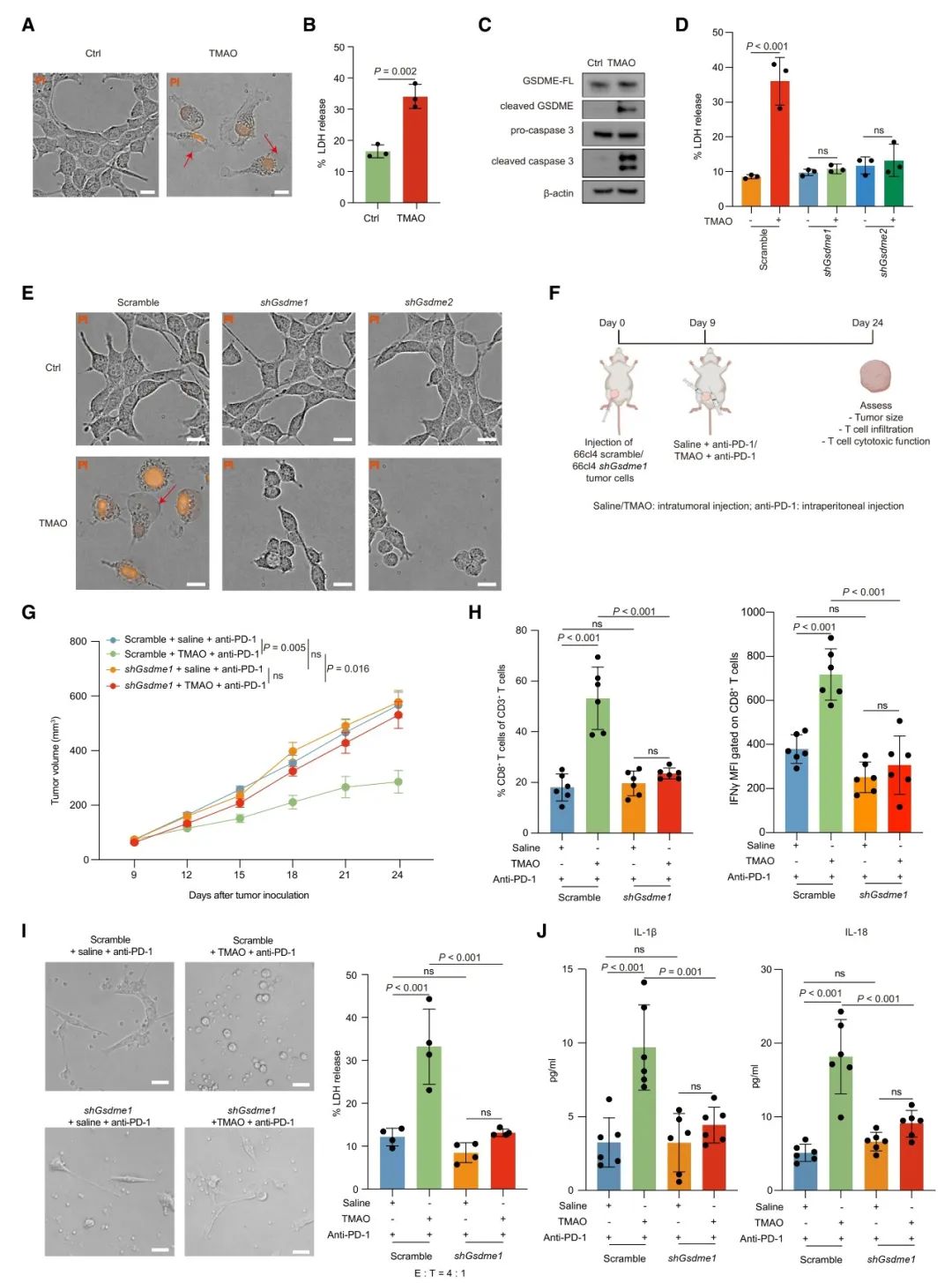
本研究結果也表明,TMAO通過GSDME介導細胞焦亡的機制是受內質網應激調控的。通過PERK抑制劑抑制PERK基因在體內和體外試驗中的表達,發現與對照組相比,TMAO處理顯著抑制腫瘤生長并促進CD8+ T細胞浸潤,而PERK抑制劑減弱了TMAO誘導的抗腫瘤免疫。此外,對模型小鼠使用PERK抑制劑時,抑制了TMAO誘導的內質網應激以及GASDME介導的PERK依賴性途徑的焦亡。由此可見,微生物代謝物TMAO能激活PERK介導的內質網應激,從而調控GASDME介導的焦亡在腫瘤細胞中的免疫作用。
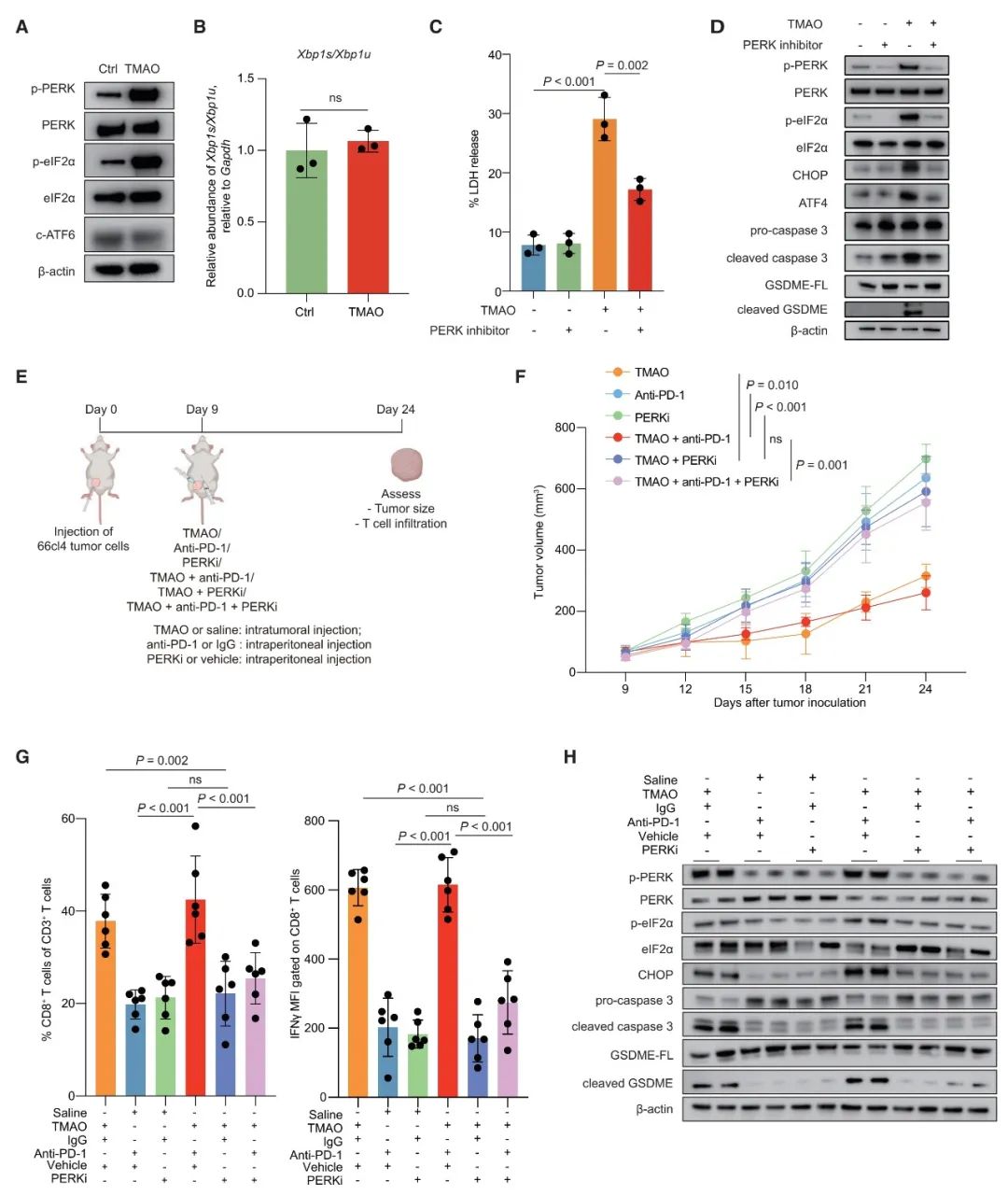
為了評價血液中的TMAO是否也能激活TNBC中的抗腫瘤免疫,本研究也收集了接受PD-1抑制劑治療的患者血漿樣本并檢測其中的TMAO含量。結果表明,血漿TMAO濃度與免疫治療的最佳反應呈正相關。此外,血漿TMAO濃度高的患者,有更長的生存期和更好的免疫治療反應。而對血漿中分離的CD8+ T細胞的體外實驗結果表明,血漿TMAO濃度更高的患者分離的CD8+ T細胞在共培養實驗中,表現出更強的細胞毒性活性。這將更有利于患者的免疫治療。
由于血漿TMAO含量高的患者對免疫治療展現出更好的效果,本研究繼續通過實驗動物模型探討了血漿TMAO升高是否可以激活抗腫瘤免疫并抑制體內腫瘤生長。結果顯示,腹膜內共同注射TMAO和PD-1抗體的小鼠,比單獨注射PD-1抗體的小鼠更顯著地抑制體內腫瘤的生長。此外,與單獨注射PD-1抗體的小鼠相比,在腹膜內共注射TMAO和PD-1抗體的小鼠觀察到CD8+ T細胞浸潤增加和IFN-γ水平升高。這些結果都表明,增加血液TMAO含量能夠增強PD-1抗體對TNBC的抗腫瘤免疫,并抑制腫瘤的生長。
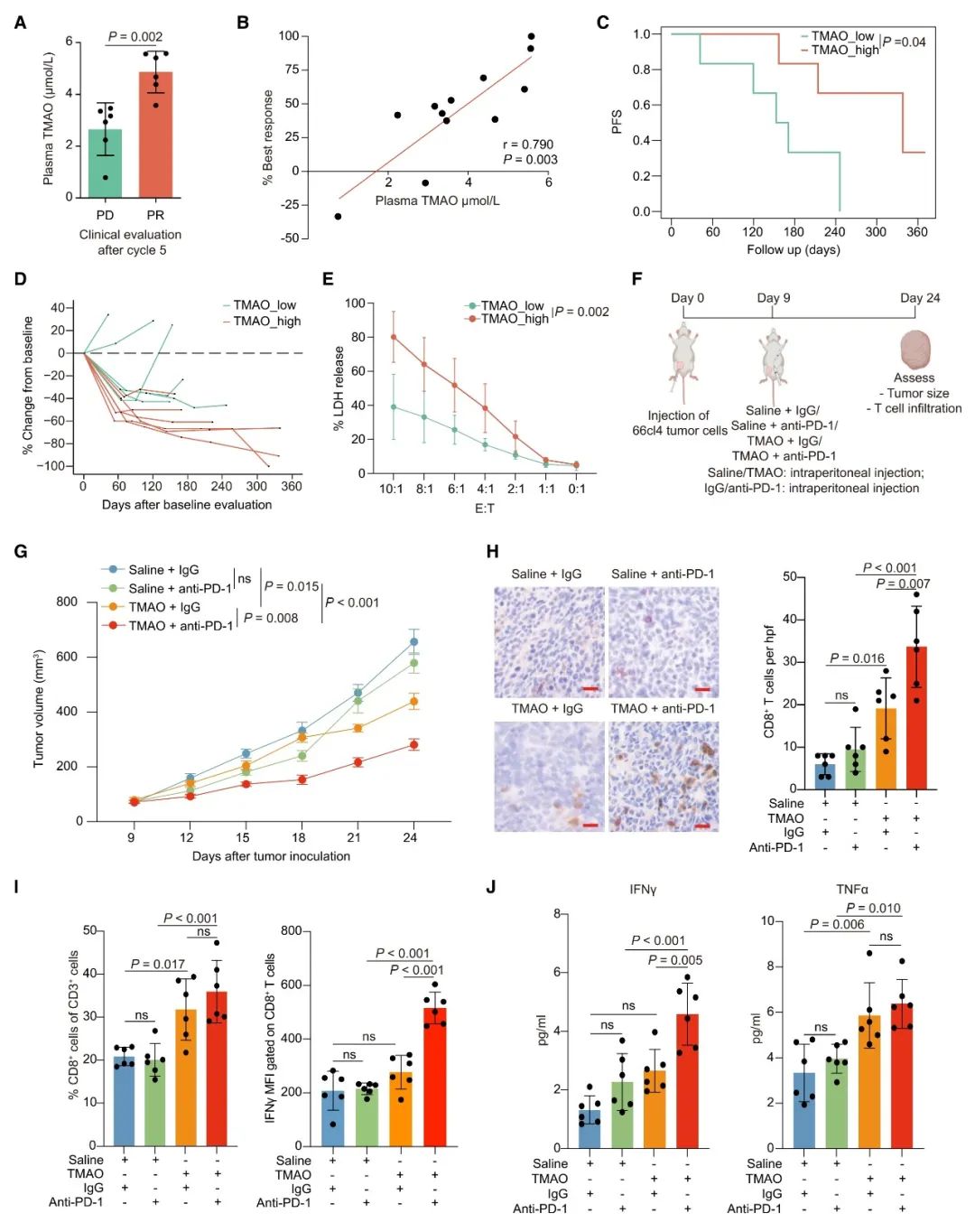
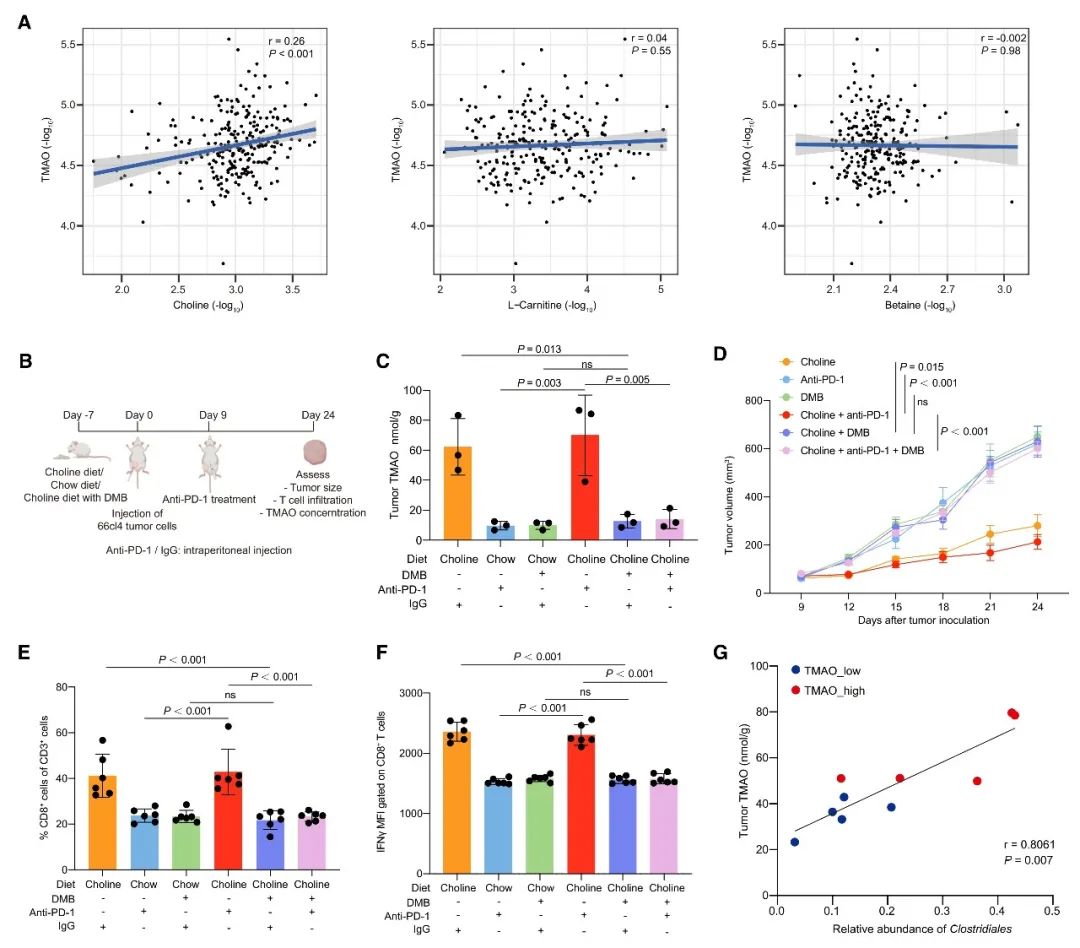
最后,本研究還發現,通過飼喂富含膽堿的飲食可上調小鼠腫瘤組織中的TMAO,并增強CD8+ T細胞浸潤,從而抑制腫瘤生長。而通過對小鼠糞便進行16S rRNA基因測序,發現腫瘤TMAO含量較高的小鼠和腫瘤TMAO含量較低的小鼠的糞便菌群差異明顯。腫瘤TMAO含量較高的小鼠糞便中,Clostridiales目的相對豐度顯著升高,并與腫瘤TMAO濃度呈正相關。同時,小鼠糞便中差異微生物的變化與TNBC患者腫瘤中觀察到的差異菌群的變化基本一致。由此表明,共生腸道微生物組可以調節腫瘤的TMAO水平,而富含膽堿的飲食可能是激活TNBC患者的抗腫瘤免疫的潛在可行的治療方法。
研究結論
綜上所述,本研究提供了共生菌群影響宿主腫瘤免疫能力的新視角。特定的微生物代謝產物及其前體分子可作為調節腫瘤免疫微環境,從而改善TNBC免疫治療效果的潛在干預策略。因此,微生物代謝產物TMAO可能具有提高TNBC免疫治療效果的臨床潛力,為TNBC的精準免疫治療提供了新的思路;
值得注意的是,TMAO被認為是能增加心血管等炎癥相關疾病風險的“有害”代謝物,而本研究則再次提醒,菌群及其代謝物的好與壞不能一概而論,而是需要具體情況具體分析;
同時,本研究證實,補充膽堿攝入可以激活TNBC抗腫瘤免疫,提高免疫治療療效。膽堿是人體日常攝入的營養物質之一,常見于蛋白、魚肉、牛肉中,安全性較好,在以往臨床中常被用作營養補劑。因此,補充膽堿攝入有望成為提高TNBC免疫治療療效的臨床潛在治療策略。
本研究的測序和部分數據分析工作由上海派森諾生物科技有限公司完成。
文章索引:
Wang H, Rong X, Zhao G, Zhou Y, Xiao Y, Ma D, Jin X, Wu Y, Yan Y, Yang H, Zhou Y, Qian M, Niu C, Hu X, Li DQ, Liu Q, Wen Y, Jiang YZ, Zhao C, Shao ZM. The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer. Cell Metab. 2022 Apr 5;34(4):581-594.e8. doi: 10.1016/j.cmet.2022.02.010. Epub 2022 Mar 11. PMID: 35278352.