
2022-06-07

《Bioactive Materials》
影響因子:14.59
文章題目:Human bone marrow mesenchymal stem cell-derived extracellular vesicles inhibit shoulder stiffness via let-7a/Tgfbr1 axis
技術手段:外泌體smallRNA 測序等
派森諾與上海市第一人民醫院攜手合作,在國際著名期刊《Bioactive Materials》上發表人骨髓間充質干細胞來源的細胞外囊泡對纖維化治療作用的研究成果。
研究背景
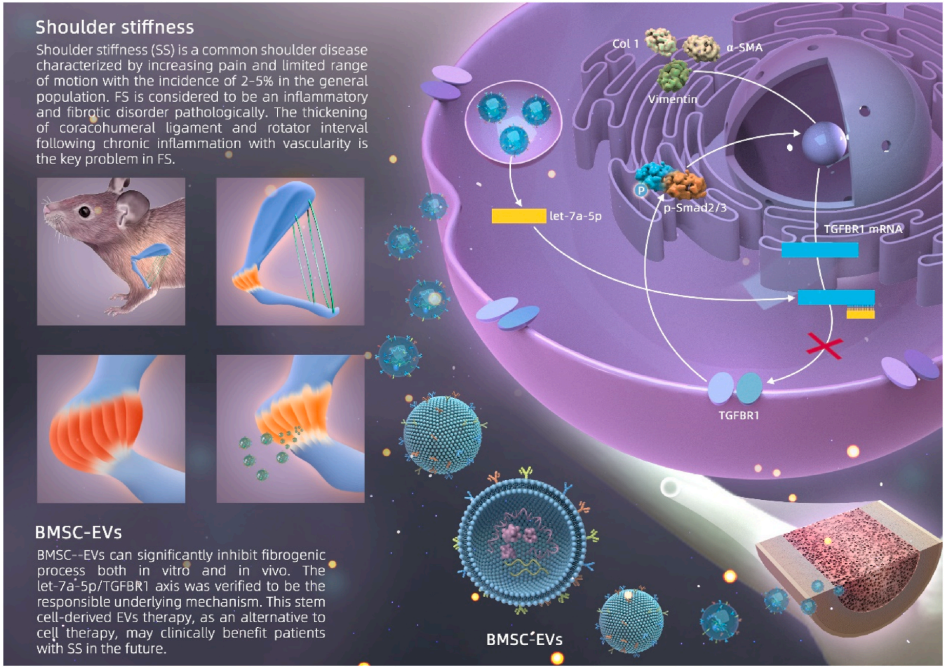
肩關節僵硬(SS)是一種常見的肩關節疾病,其特點是疼痛加重和活動范圍受限。SS在病理上被認為是一種炎性和纖維化疾病。然而,對于纖維化最有效的保守治療方法還沒有達成共識。鑒于人骨髓間充質干細胞來源的細胞外囊泡(BMSC-EVs)對各種組織具有良好的治療效果,研究通過小鼠固定模型和兩種細胞模型研究了BMSC-EVs對纖維化的治療作用。通過一系列實驗發現,闡明了BMSC-EVs在肩關節纖維化中的抗纖維化作用。這項研究闡明了一種新的方法,使用干細胞來源的EV治療作為細胞治療的替代,這可能在未來臨床受益SS患者。
技術路線
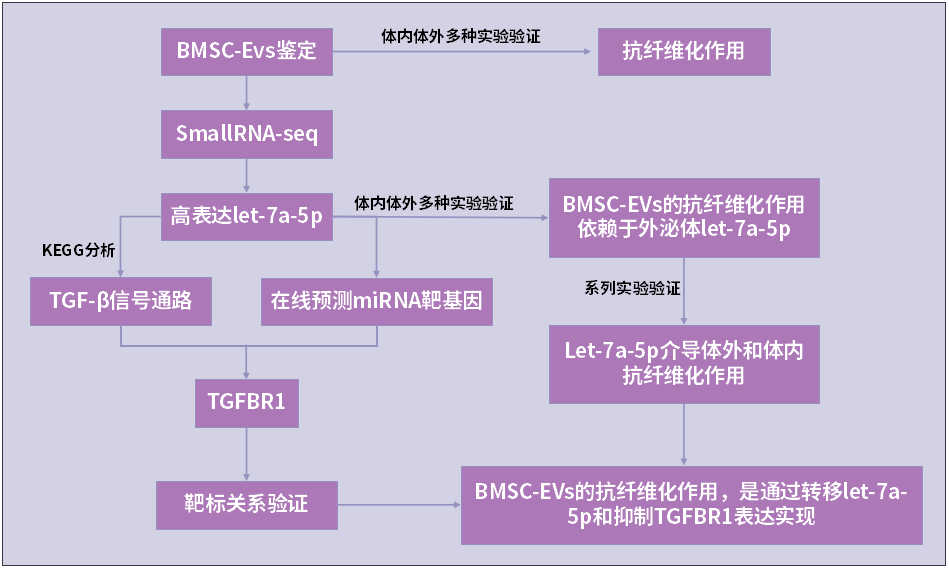
研究內容
BMSC-EVs鑒定與表征
首先,研究對骨髓干細胞誘導分化能力及生物學特性進行鑒定。進一步通過電鏡、WB及NTA,對BMSC-EVs的形狀、外泌體marker蛋白及外泌體直徑、濃度等進行鑒定。
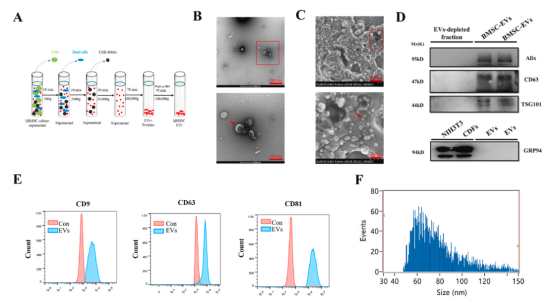
圖1 骨髓間充質干細胞來源的細胞外囊泡
BMSC-EVs可抑制TGF-β誘導的體外纖維形成與小鼠模型凍結肩部
BMSC-EVs可以被來自RCT隊列和NIH3T3的cdf內化。TGF-β是一種強大的促纖維化因子,存在于肩關節硬化的關節囊中,與RCT組相比,在SS組樣本中高表達。因此,在體外實驗中,本研究利用該因子來模擬體內纖維化的細胞外環境。通過BrdU染色、創面愈合實驗和CCK-8實驗(圖2A至E),發現BMSC-EVs顯著抑制TGF-β誘導的CDFs活性增強,且呈濃度依賴性。此外,膠原收縮分析進一步證明,BMSC-EVs抑制TGF-β干預下CDFs介導的膠原收縮(圖2G, 2H定量)。同樣,免疫熒光染色(圖2F,圖2I定量)和western blot(圖2J,圖2K定量)檢測到TGF-β刺激CDFs中ev引起的Col 1、α-SMA和VIM蛋白表達顯著降低,提示BMSC-EVs具有抗纖維化作用。實驗進一步NIH3T3成纖維細胞來評價BMSC-EVs對纖維化表型的影響,使上述結果更有說服力。
隨后,在SS小鼠模型上研究了BMSC-EVs對體內纖維化的影響,結果表明,BMSC-EVs在體外和體內均具有抗纖維化的潛能。
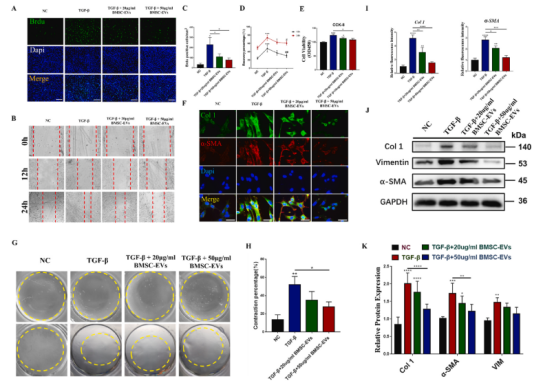
圖2 BMSC-EVs可緩解TGF-β誘導的CDFs成纖維
Let-7a-5p在BMSC-EVs中高表達
為了發現具有抗纖維化作用的BMSC-外泌體miR,我們對三組BMSC-EVs進行了外泌體miRNA測序。檢測出前10個表達miRNA,分別為let-7a-5p、let-7a-3p、let-7b-5p和let-7b-3p(圖3A)。GO分析表明,各種生物學過程、分子功能和細胞成分都參與了mir相關功能(圖3B和D,圖4 G-L) 。此外,通過KEGG分析,確定了幾種信號通路,其中TGF-β信號通路是著名的促纖維化信號通路,(圖3C和E)。這些活動強調了抗纖維化過程中BMSC-EVs的作用。此外,PCR結果顯示,不同濃度的BMSC-EVs處理后,let-7a-5p在CDFs中表達顯著,而let-7a-3p、let-7b-5p和let-7b-3p的表達沒有顯著變化(圖3I-L)。
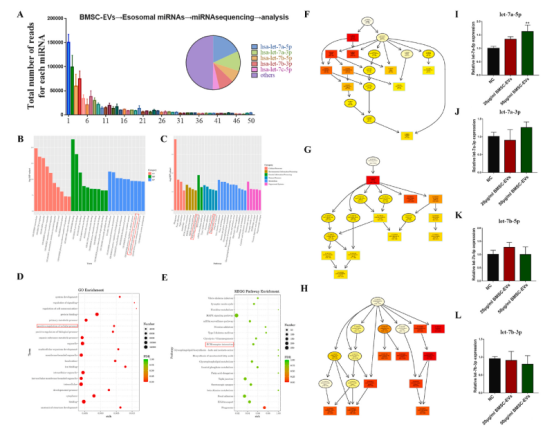
圖3 SmallRNA-seq,GO/KEGG分析,驗證miRNAs表達
圖4 測序質量和詳細的GO分析信息
TGFBR1是let-7a-5p的靶標
通過miRNA在線預測網站(Targetminer, miRWalk, starBase, mirDIP)預測靶基因,然后使用DIANA工具選擇KEGG預測的TGF-β信號通路中重疊的基因。最終確定TGF-β信號通路的重要受體TGFBR1為let-7a-5p的靶基因(圖5A)。通過雙熒光素酶報告基因檢測驗證靶標關系。PCR和western blot結果顯示,let-7a-5p mimics明顯抑制TGFBR1表達,而let-7a-5p inhibitor顯著增強TGFBR1表達(圖5D-F)。
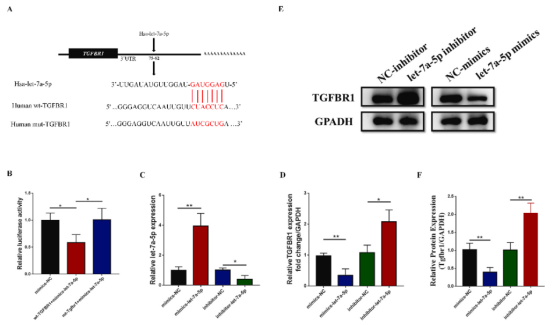
圖5 TGFBR1是let-7a-5p的直接靶標
BMSC-EVs的抗纖維化作用依賴于外泌體let-7a-5p
通過系列實驗發現,BMSC-EVs抑制TGF-β相關的纖維化表型。因此,實驗將BMSC-EVs或BMSC-EVs let?7a?D注射到CDF中,研究發現let-7a-5p敲除顯著抑制了BMSC-EVs的抗纖維化作用。在BMSC-EVs let?7a?D組中,CCK-8細胞活力、BrdU細胞增殖能力和創面愈合能力被BMSC-EVs抑制后重新上調。同時,western blot和免疫熒光結果顯示,TGFBR1、p-Samd2/3、Col 1和α-SMA的表達被BMSC-EVs抑制,而在BMSC-EVs let?7a?D組中升高。進一步通過體內與體外實驗驗證上述實驗結果。
隨后,研究進行了一系列體內體外實驗來驗證let-7a-5p的抗纖維化潛能。這些結果表明,人類BMSC-EVs的抗纖維化作用依賴于靶向TGFBR1的外泌體let-7a-5p。
研究結論
研究闡明了BMSC-EVs的抗纖維化作用,這是通過轉移let-7a-5p和抑制TGFBR1表達實現的。這項研究闡明了一種新的方法,使用干細胞來源的EV治療作為細胞治療的替代,這可能對未來的肩僵硬患者有臨床益處。
本研究的外泌體SmallRNA測序和數據分析工作由上海派森諾生物科技有限公司完成。
原文索引:
Luo Z, Sun Y, Qi B, Lin J, Chen Y, Xu Y, Chen J. Human bone marrow mesenchymal stem cell-derived extracellular vesicles inhibit shoulder stiffness via let-7a/Tgfbr1 axis. Bioact Mater. 2022 Jan 23;17:344-359. doi: 10.1016/j.bioactmat.2022.01.016. PMID: 35386460; PMCID: PMC8965035.