
2022-04-28
隨著測序技術的發展,想要更加全面深層次的剖析生物學問題,越來越多的科學家會選擇多種組學搭配,聯合解析具體機制。今天我們就對一篇經典的《Cell》多組學文章進行解析,看單細胞數據如何和其他組學數據進行關聯。

研究背景
肥胖在西方比較常見,是至少13種癌癥的風險因素(Lauby-Secretan et al., 2016)。肥胖可以引起機體代謝的系統性紊亂,導致血脂異常、高膽固醇血癥、胰島素抵抗、激素水平改變和炎癥基線改變(Deng et al.,2016)。以往關于肥胖和癌癥的研究主要集中在腫瘤的內在效應或腫瘤細胞的內分泌調節軸上。肥胖誘導的全身代謝變化如何影響局部腫瘤微環境(TME)中的免疫細胞尚未見報道。
腫瘤細胞代謝的一個顯著特征是增加營養消耗,以滿足能量、合成代謝和促生存的需求。活化的T細胞是高度增殖的,并依賴于特定的代謝途徑來維持T細胞效應功能。由于實體腫瘤的血液供應有限,腫瘤細胞的高營養消耗可能會對腫瘤內T細胞的代謝需求構成障礙。眾所周知,腫瘤細胞代謝會以抑制抗腫瘤免疫的方式改變局部代謝景觀的許多方面。然而,系統代謝如何影響TME內的局部代謝以及肥胖如何影響腫瘤和免疫細胞之間的相互作用尚不清楚(Drijvers et al.,2020)。
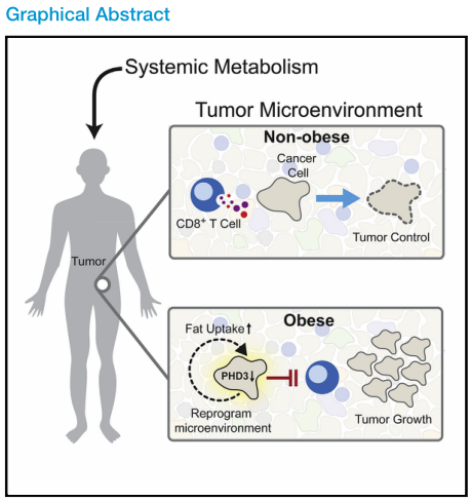
本文旨在研究肥胖如何改變TME的代謝,以抑制T細胞功能和促進腫瘤生長。主要利用代謝、蛋白質組學和基因組學方法,以及多重組織成像,利用小鼠腫瘤模型系統地剖析了飲食誘導的肥胖如何重塑TME中的代謝。并結合單細胞RNA測序來描述TME中免疫亞群對肥胖的代謝反應。這些多組學數據揭示了單細胞分辨率下腫瘤免疫細胞與高脂肪飲食誘導的肥胖相互作用的動態圖景,并得出結論,在肥胖相關的腫瘤中,適應性的代謝可塑性會引發腫瘤細胞和CD8+T細胞對有益脂肪酸的爭奪,提示對代謝的干預能改善腫瘤免疫治療。
研究思路
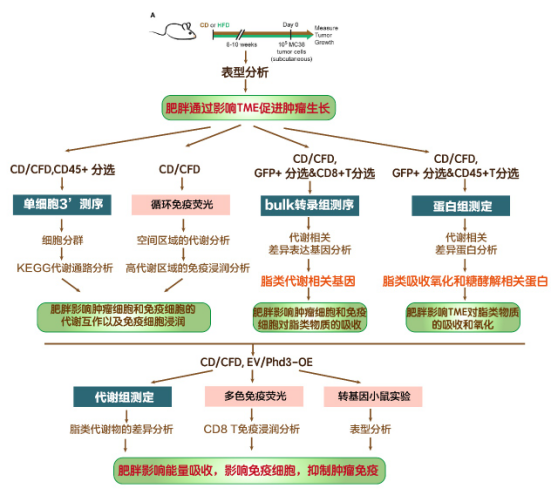
研究結果
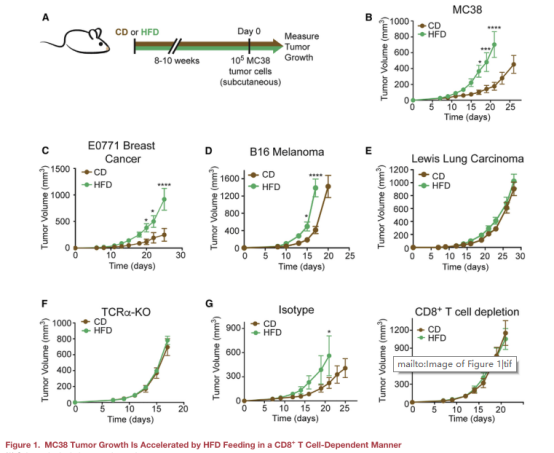
一、高脂飲食(HFD)通過CD8+ T細胞依賴性促進MC38腫瘤生長
本文使用C57BL/6J小鼠建立肥胖模型,模型隨機分為正常飲食組(CD)與高脂飲食組(HFD),隨著小鼠生長時間變長,HFD組的小鼠體重明顯增長更多,并出現了一系列肥胖相關的代謝變化(圖A)。對模型注射MC38 結直腸腺癌細胞,發現腫瘤在HFD組生長更快(圖B)。此外,注射三種不同免疫原性水平的腫瘤的模型進行比較,發現免疫原性會影響腫瘤生長(圖CDE)。
為了探究CD動物腫瘤生長速度的降低是否由于T細胞控制的,本文將MC38腫瘤植入T細胞受體a鏈敲除(TCRa-KO)小鼠中。結果發現TCRa-KO小鼠在HFD條件下的體重增加與野生型(WT)小鼠相似,CD和HFD組TCRa-KO小鼠的MC38腫瘤生長速度沒有差異(圖F)。同樣,在缺乏CD8+T細胞的小鼠中,腫瘤生長速度也沒有發生飲食依賴的變化(圖G)。在這兩種情況下,CD8+ T細胞減少均會加速腫瘤的生長,以上證明HFD誘導的代謝變化通過限制抗腫瘤CD8+T細胞的反應來增加MC38腫瘤的生長。
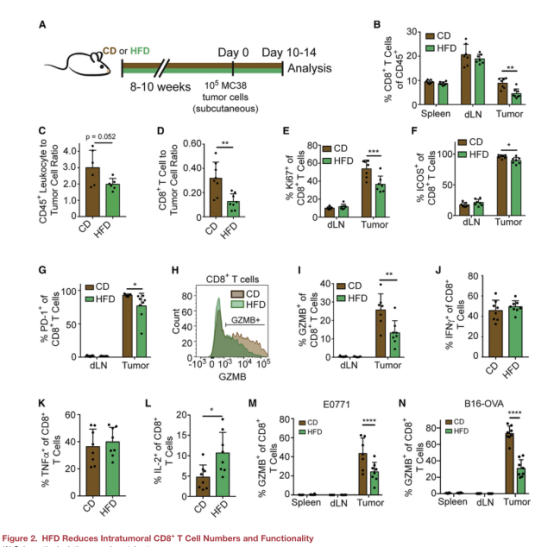
二、高脂飲食(HFD)降低腫瘤內CD8+ T細胞的數量和功能
為了了解HFD如何改變MC38腫瘤的免疫景觀,文章使用流式細胞技術分析了植入10-14天的腫瘤浸潤免疫細胞群(圖A)。發現HFD組的MC38腫瘤中CD8+T細胞數量更少,但在脾臟和引流淋巴結中并沒有減少(圖B),且HFD組白細胞/腫瘤細胞比更低(圖C),CD8+T細胞/腫瘤細胞比也更低(圖D)。為了研究HFD對腫瘤中CD8+ T細胞活性和功能的影響,文章檢測了反映T細胞功能的一些標志的情況(圖E-N))。最終發現HFD在許多飲食敏感的腫瘤模型中導致腫瘤內T細胞功能降低。通過體外實驗發現,CD8+T細胞增殖和狀態的變化是針對體內HFD環境的,似乎不涉及T細胞激活的內在缺陷。
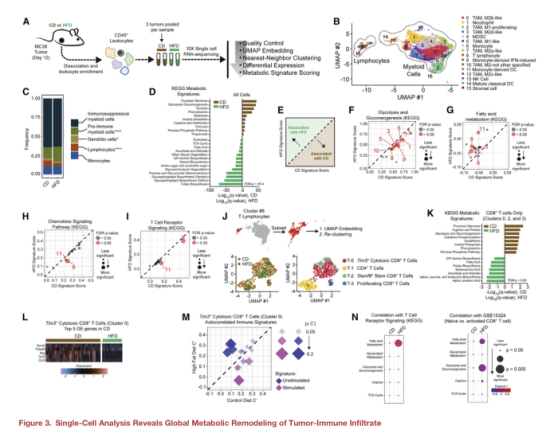
三、單細胞RNA測序提示飲食誘導腫瘤浸潤免疫細胞群的改變
使用來自CD和HFD MC38腫瘤浸潤CD45+白細胞進行單細胞RNA-seq,繪制腫瘤免疫轉錄圖譜(圖A),確定了16個不同的細胞簇(圖B)。結果顯示HFD組淋巴細胞顯著減少,而免疫抑制髓系細胞群的相對比例未發生變化(圖C)。為了在單細胞分辨率上繪制與肥胖相關的代謝改變,將61個KEGG代謝基因標記到所有細胞,發現CD組腫瘤的白細胞富集糖代謝及氧化還原途徑,而HFD組則富集脂肪膽固醇代謝、葉酸合成、戊糖與葡糖醛酸轉換相關途徑(圖D),且與單核細胞、T細胞和M2 TAMs相對應的聚類#6、#8和#10對HFD特別敏感(圖E-G)。
對參與代謝調節和免疫活性的KEGG信號特征進行分析后,發現在T淋巴細胞(簇8)中,HFD顯著降低趨化因子信號和T細胞受體信號(圖H,I)。之后的T細胞亞群分類分析,發現了與T細胞活化相關的CD富集的代謝特征(圖K)。由于T-2和T-3細胞群中細胞數量較少,隨后文章重點分析了T-0 Tim3+細胞毒性CD8+ T細胞群。差異分析表明CD組CD8+T細胞中富集的前5個基因參與了T細胞效應功能(圖L)。與未受刺激的或未受刺激的T細胞相關的信號傾向于在HFD富集,而與受刺激的T細胞對應的信號傾向于在CD富集(圖M)。對T細胞刺激信號與CD組和HFD組內 CD8+T細胞的一組核心KEGG代謝途徑之間的相關性進行計算發現代謝途徑與HFD 組內TME中的T細胞活化更顯著相關(圖N)。
單細胞的分析顯示,TME中的免疫細胞在響應HFD時經歷了獨特的代謝適應,并且這種差異在T細胞中是獨特的,T細胞顯示了主要中心碳代謝途徑的表達改變。
四、HFD重塑TME中的腫瘤免疫景觀
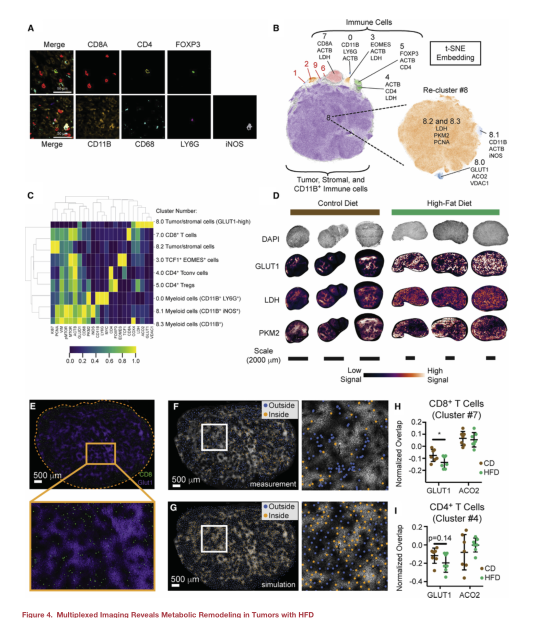
CD8+T細胞殺傷腫瘤細胞需要細胞與細胞的直接接觸和足夠的代謝資源。因此,為了了解肥胖是否會影響TME中TILs的位置,以及T細胞在腫瘤中的位置是否與腫瘤內代謝生態位的變化有關,使用循環免疫熒光(CyCIF)繪制了TME中細胞的位置和狀態,從而實現了多路組織成像。通過對標記的表達模式和代謝特征評分計算來判定細胞群(圖A-B),共識別出9個不同的細胞型(圖C)。結果顯示細胞類型和跨TME的代謝和細胞狀態標記的表達有實質性的變化。值得注意的是,糖酵解標志物(GLUT1、PKM2和LDH)的表達在腫瘤中是不均勻的,有亮染色區域和暗染色區域(圖D)。為了確定腫瘤間代謝狀態的變化是否與免疫細胞的位置在空間上相關,本文測量了免疫細胞群體和腫瘤中GLUT1或ACO2高表達區域之間的重疊,將位于腫瘤內高GLUT1或高ACO2區域的CD8+T細胞的比例(圖E,F)與涉及相同數量CD8+T細胞的模擬零分布進行了比較(圖G),發現CD4+和CD8+ T細胞在glut1高區域的豐度明顯低于預期。為了確定飲食是否會改變T細胞避免glut1高區域的傾向,將CD8+T細胞和glut1高區域的重疊百分比歸一化到相應的模擬分布來控制每種組織的細胞密度差異。在HFD腫瘤中,CD8+和CD4+T細胞與GLUT1的歸一化重疊減少(圖H,I)。這些數據表明,HFD的攝入改變了腫瘤內的代謝生態位相互作用,并影響了局部T細胞浸潤模式。
五、HFD導致CD8+T細胞和腫瘤細胞的相反代謝變化
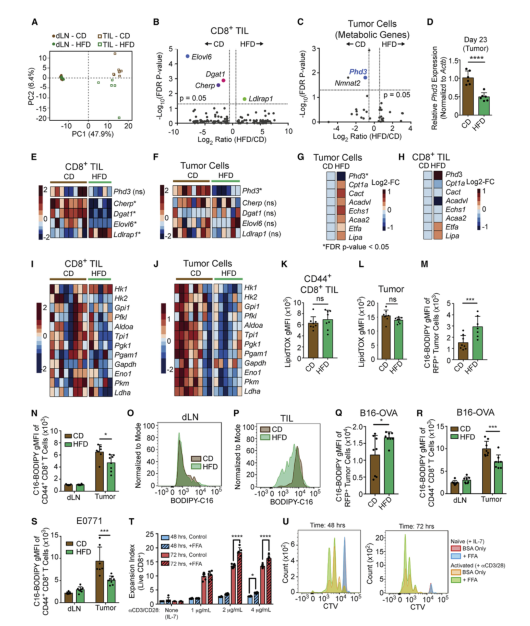
CD8+T細胞依賴許多與腫瘤細胞相同的燃料來源和代謝途徑以支持增殖、生存和效應功能。為了研究飲食如何影響腫瘤中不同類型細胞的代謝重編程,使用bulk RNA-seq對GFP+ MC38腫瘤細胞、CD8+ TILs和CD8+ T細胞進行篩選。主成分分析發現,來自于腫瘤和dLN的T細胞,以及CD組和HFD組TILs發生分離(圖A),提示肥胖所致的CD8+T細胞改變為TME特有。為了理解CD8+T細胞的TME特異適應性反應,對CD8+TILs轉錄水平的變化進行研究,發現在HFD組有4個基因的表達顯著不同,其中3個與脂肪合成或膽固醇代謝有關(圖B)。CD8+TILs轉錄水平變化與腫瘤細胞不重疊(圖C-F),為HFD的獨特代謝適應提供了證據。此外,還發現HFD腫瘤細胞在基因表達上和CD+TILs有差異(圖G-I)。這些數據揭示了腫瘤細胞和CD8+ TILs對HFD系統應激的代謝適應,包括脂肪代謝的變化都不同。
六、HFD重新編程TME中的脂肪利用率(同五圖)
中性脂質積累檢測發現在兩種飲食中,CD8+ TILs和MC38腫瘤細胞都含有類似水平的中性脂質(圖K,L)。體外棕櫚酸內流檢測發現,來自HFD小鼠腫瘤細胞比CD組的攝取更多的脂肪酸(圖M)。在相同的微環境中,腫瘤固有脂肪利用的改變可能會影響CD8+T細胞對脂肪的攝取。雖然飲食沒有改變dLN中CD8+T細胞對棕櫚酸鹽的基線攝取(圖N和O),但從HFD喂養的小鼠中CD44+ CD8+ TILs從培養基中獲得的棕櫚酸鹽少于CD對照組(圖N和P)。在B16-OVA-RFP和E0771腫瘤中也是如此(圖Q-S)。因此,腫瘤和CD8+T細胞似乎以不同的方式重新連接它們的代謝:腫瘤細胞適應并增加脂肪酸的利用,而CD8+ T細胞沒有。腫瘤細胞脂肪酸攝取增強可能導致在TME中的T細胞缺少脂肪酸,在含有少量脂肪酸的含血清的炭剝離培養基中體外激活的幼稚CD8+T細胞,在脂肪酸的補充下增殖更好(圖T-U)。這些發現表明,ME中單個細胞群對系統性代謝紊亂(肥胖)產生不同的反應,導致免疫細胞和腫瘤細胞之間脂肪酸利用的差異。
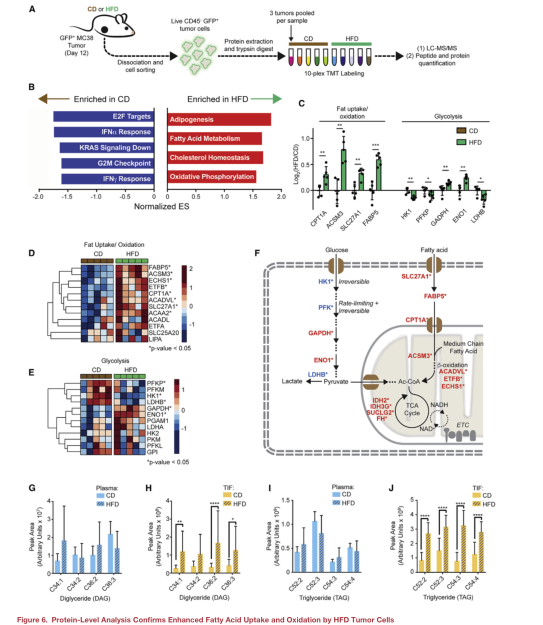
七、蛋白質組學分析揭示HFD腫瘤細胞的脂肪酸攝取和氧化特征
為了從分子上更深入地了解腫瘤細胞對HFD的適應,使用TMT蛋白組技術對從CD或HFD腫瘤中篩選的GFP+腫瘤細胞的蛋白質組進行了比較(圖A)。發現脂肪酸代謝和氧化磷酸化是HFD腫瘤細胞中最富集的途徑之一(圖B)。HFD通過轉運蛋白、脂肪酸結合蛋白和參與線粒體β-氧化的蛋白的誘導,支持腫瘤中的脂肪利用(圖C、D和F)。相反,催化不可逆和/或速率限制步驟的糖酵解酶被HFD下調(圖C-F)。
八、HFD改變TME中性脂質組成(同結果七圖)
由于脂肪氧化信號在HFD的腫瘤細胞中高度富集,本文進行了靶向脂質組學,以測量HFD對循環和TME中脂質水平的影響。分析了血漿和GFP+MC38腫瘤細胞、腫瘤間質液(TIF)兩個瘤內腔室的脂質組成。發現HFD組和CD組所有脂質的TIF/血漿比成正相關,甘油三酯(TAG)和甘油二酯(DAG)在對角線外,在去除了這兩類脂后HFD組和CD組相關性更好,表明DAG和TAG水平是飼喂HFD小鼠TME的主要差異。TAG和DAG中的前四名(按峰值計)在HFD的TIF中顯著富集,但在血漿中沒有富集(圖G-J)。
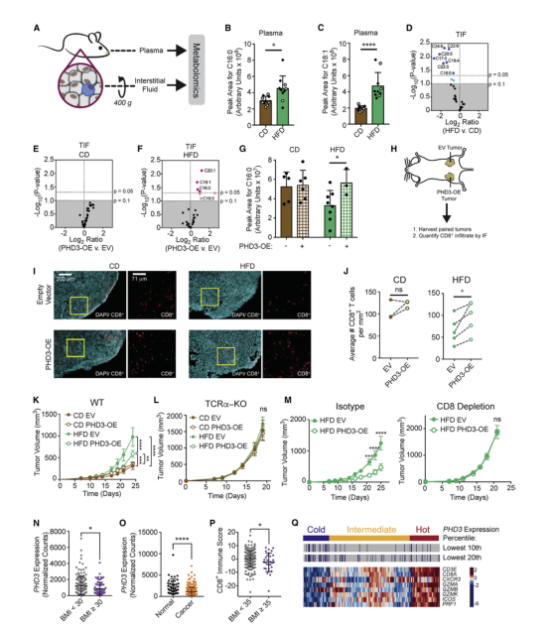
九、腫瘤細胞PHD3表達控制HFD的TME中脂肪酸的可用性
由于前面發現HFD通過重編程TME來增強腫瘤中脂肪的攝取,因此推測HFD誘導的腫瘤細胞脂肪代謝的改變可能會影響TME中FFA的有效性和CD8+ T細胞的功能。且預防HFD誘導的代謝重組可以恢復CD8+ T細胞的反應,并防止腫瘤在HFD上的增長。為了驗證以上推論,在MC38細胞中過表達了PHD3。為了進一步驗證腫瘤細胞中PHD3的表達調節FFAs的局部有效性的假設,文章使用靶向代謝組學測量MC38腫瘤血漿中的FFAs和TIF(圖A)。發現HFD增加了許多FFAs的循環水平,包括棕櫚酸和油酸(C16:0和C18:1)(圖B、C)。相比之下,與CD相比,HFD組動物TIF中局部FFA水平降低(圖D)。比較MC38 PHD3-OE和空載體對照腫瘤中TIF中FFA的相對水平發現PHD3過表達對CD TIF中FFA水平沒有顯著影響(圖E),但在HFD中,一些FFA在PHD3-OE TIF中增加(7F)。循環中構成主要脂質碳源的FFAs,包括棕櫚酸鹽和油酸鹽(C16:0和18:1),是變化顯著的脂肪酸之一(圖F)。值得注意的是,腫瘤細胞PHD3過表達足以恢復TME中棕櫚酸的可用性(圖G)。因此,恢復腫瘤細胞中PHD3表達能改變TME中的營養可用性。
此外文章測試了改變MC38細胞中PHD3的表達是否會影響CD8+T細胞對腫瘤的控制。將ev-轉導和PHD3-OE MC38腫瘤細胞注射到飼喂CD或HFD的小鼠的相反側,并測量腫瘤內CD8+ T細胞的數量和定位(圖H)。MC38腫瘤切片用DAPI染色顯示整體結構,然后用CD8染色顯示CD8+T細胞浸潤(圖I)。定量圖像顯示HFD中CD8+T細胞減少,腫瘤周圍或內部的CD8+ T細胞定位未發生重大變化(圖J)。PHD3在腫瘤細胞中的過表達顯著增加了HFD動物中CD8+T細胞的浸潤(圖J),這證明改變腫瘤細胞中的代謝途徑可以通過非細胞自主機制影響腫瘤控制。
為了探索肥胖是否會改變人類患者的腫瘤代謝狀況,文章分析了TCGA中可獲得的結腸腺癌(COAD) RNA-seq數據集和相應的BMI數據。在BMI為R30 kg/m2的肥胖患者的腫瘤中,PHD3的表達顯著降低,而PHD1或PHD2的表達則沒有降低(圖N)。且發現與COAD患者的正常組織相比,腫瘤組織中PHD3的表達降低(圖O)。此外,嚴重肥胖(BMI≥35kg/m2)患者腫瘤中CD8+T細胞浸潤減少(圖P)。以PHD3表達為10%或20%作為切割點,將患者樣本分為高PHD3或低PHD3組。然后,根據CD8+基因特征得分,將患者樣本分為免疫學上的“熱”、“中間”或“冷”類別(圖Q)。這些數據表明,PHD3的下調發生在人類癌癥中,并與免疫力的降低有關。
研究結論
肥胖是一個主要的癌癥危險因素,但系統代謝的差異如何改變腫瘤微環境(TME)和影響抗腫瘤免疫尚不清楚。本文證明了高脂飲食(HFD)誘導的肥胖損害小鼠TME中的CD8+T細胞功能,加速腫瘤生長。文章生成了TME中細胞代謝的單細胞分辨率圖譜,詳細描述了它如何隨著飲食誘導的肥胖而變化。并發現腫瘤細胞和CD8+ T細胞對肥胖表現出不同的代謝適應。腫瘤細胞通過HFD增加脂肪攝取,而浸潤腫瘤的CD8+T細胞則不會。這些不同的適應導致HFD腫瘤中脂肪酸分配的改變,損害CD8+T細胞浸潤和功能。阻斷肥胖小鼠腫瘤細胞的代謝重編程可以提高抗腫瘤免疫。對人類癌癥的分析顯示在CD8+T細胞標記物中有類似的轉錄變化,這表明可以考慮利用代謝干預來改善癌癥免疫治療。
原文索引:
Ringel AE, Drijvers JM, Baker GJ, Catozzi A, García-Ca?averas JC, Gassaway BM, Miller BC, Juneja VR, Nguyen TH, Joshi S, Yao CH, Yoon H, Sage PT, LaFleur MW, Trombley JD, Jacobson CA, Maliga Z, Gygi SP, Sorger PK, Rabinowitz JD, Sharpe AH, Haigis MC. Obesity Shapes Metabolism in the Tumor Microenvironment to Suppress Anti-Tumor Immunity. Cell. 2020 Dec 7:S0092-8674(20)31526-9. doi: 10.1016/j.cell.2020.11.009. Epub ahead of print. PMID: 33301708.