
2021-10-08

期刊:《Theranostics》
影響因子:11.556
繼去年在《Molecular Nutrition and Food Research》上發(fā)表研究論文、并被選為MNFR期刊當期的封面文章(【派森諾項目文章】榮登MNFR封面,多組學整合研究再立新功!)之后,近期,派森諾的長期合作伙伴——中國海洋大學的易華西教授團隊,和新加坡國立大學王炯偉教授團隊在生物醫(yī)學1區(qū)期刊《Theranostics》上發(fā)表論文:繼續(xù)以小鼠為模型,研究了牛乳來源的細胞外囊泡(mEVs)通過調節(jié)小鼠的腸道免疫和腸道菌群來緩解結腸炎的作用機理,旨在探討mEVs對結腸炎的治療作用。
研究背景
mEVs是牛奶中重要的活性成分。它作為納米顆粒,在細胞間通信中起關鍵作用,正被開發(fā)為新型藥物載體。不過,mEVs對腸道菌群和腸道免疫的影響尚不清楚。因此,易教授團隊以小鼠為模型,就mEVs對腸道菌群和免疫功能的影響開展了一系列的研究。
研究方法
研究對象
C57BL/6小鼠
測序技術
Illumina MiSeq PE300微生物組測序+miRNA測序+蛋白質組檢測
測序模式
多樣性組成譜16S rRNA基因V4V5區(qū)測序
實驗設計
對照組、DSS組(3% DSS)、DSS + mEVs-L組(3% DSS + 0.6 mg/kg/d,低劑量)、DSS + mEVs-M組(3% DSS + 1.8 mg/kg/d,中劑量)、DSS + mEVs-H組(3% DSS + 3.0 mg/kg/d,高劑量)
研究結果
1. mEVs的蛋白質組學和miRNA功能分析
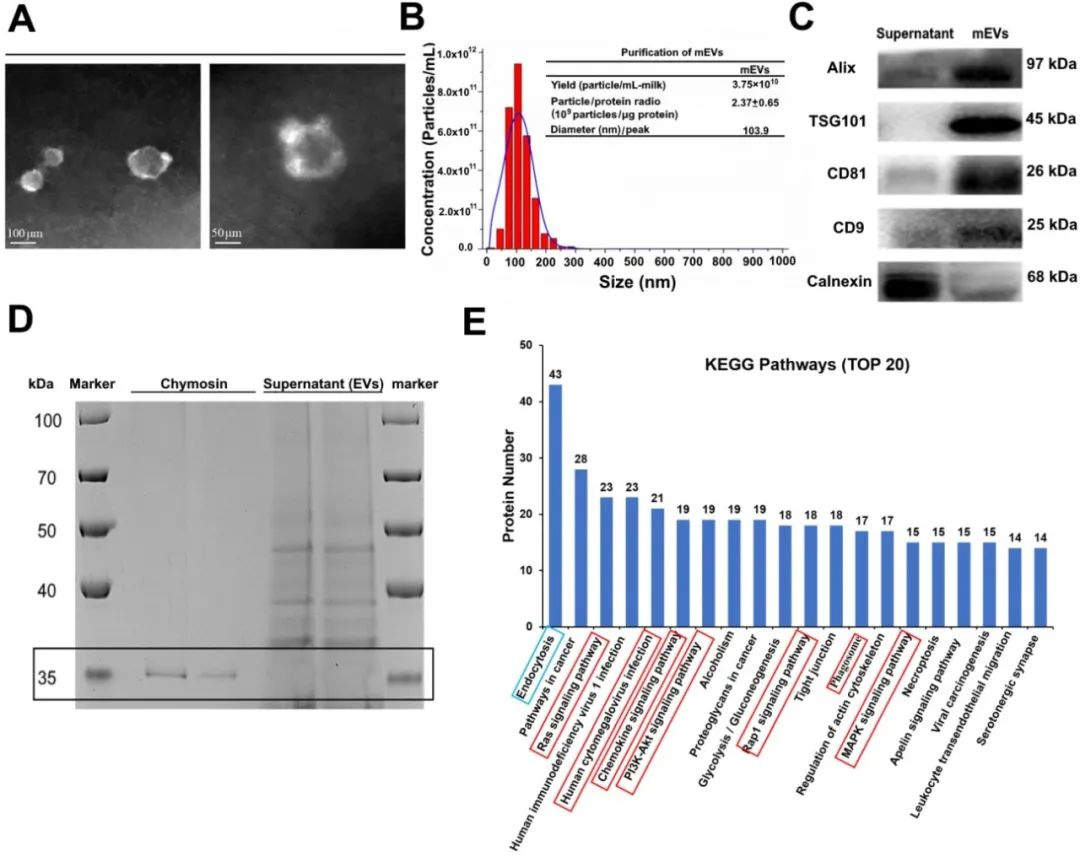
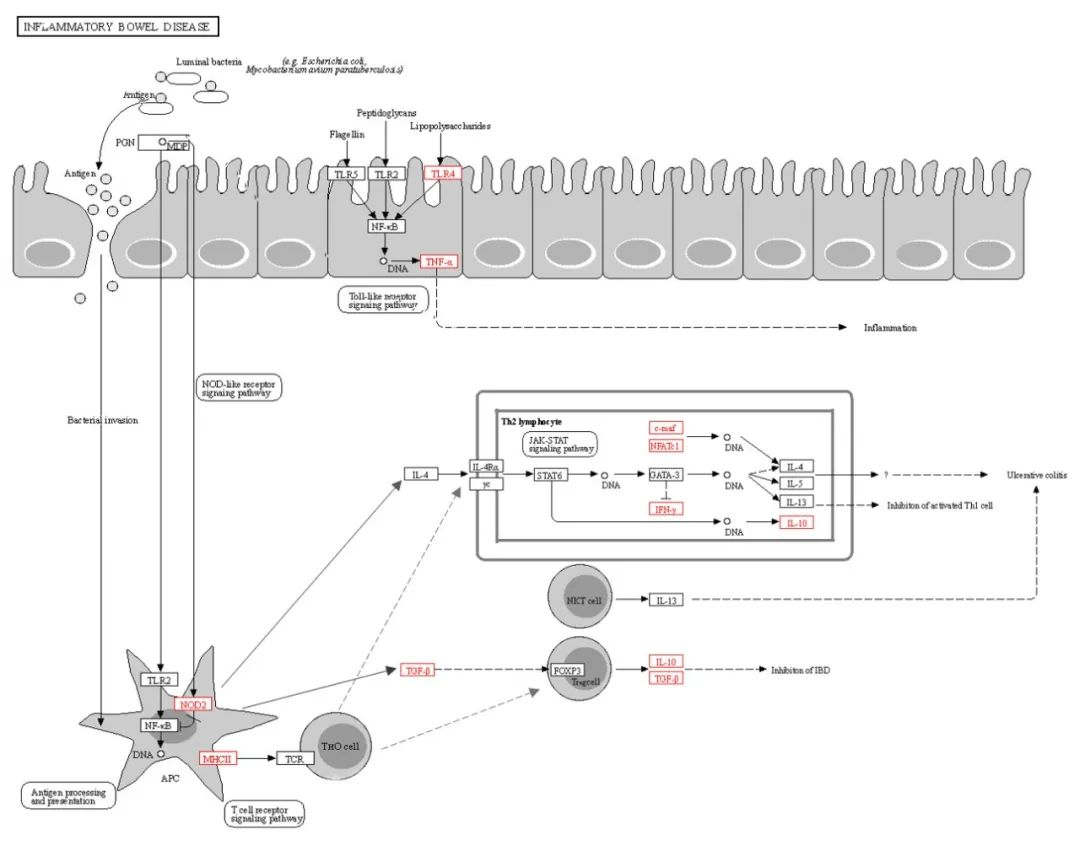
首先,本文利用蛋白質組學和miRNA測序發(fā)現(xiàn)mEVs中含有大量與免疫相關的蛋白質和miRNAs,并參與了免疫和炎癥通路的調控。比如,GO注釋表明,大多數(shù)蛋白質參與了生物過程和細胞成分;KEGG注釋表明,排名前20位的KEGG通路,其中8條通路(紅框)參與了炎癥信號通路,包括人巨細胞病毒感染、PI3K/Akt信號通路、趨化因子信號通路、MAPK信號通路等;另外,在mEVs中共鑒定出678個miRNAs,并發(fā)現(xiàn)前100個miRNA中有36個靶向炎癥途徑,其中包括10個與IBD(Idiopathic inflammatory bowel disease)有關的miRNA。
2. mEVs在DSS誘導的潰瘍性結腸炎中修復腸道免疫
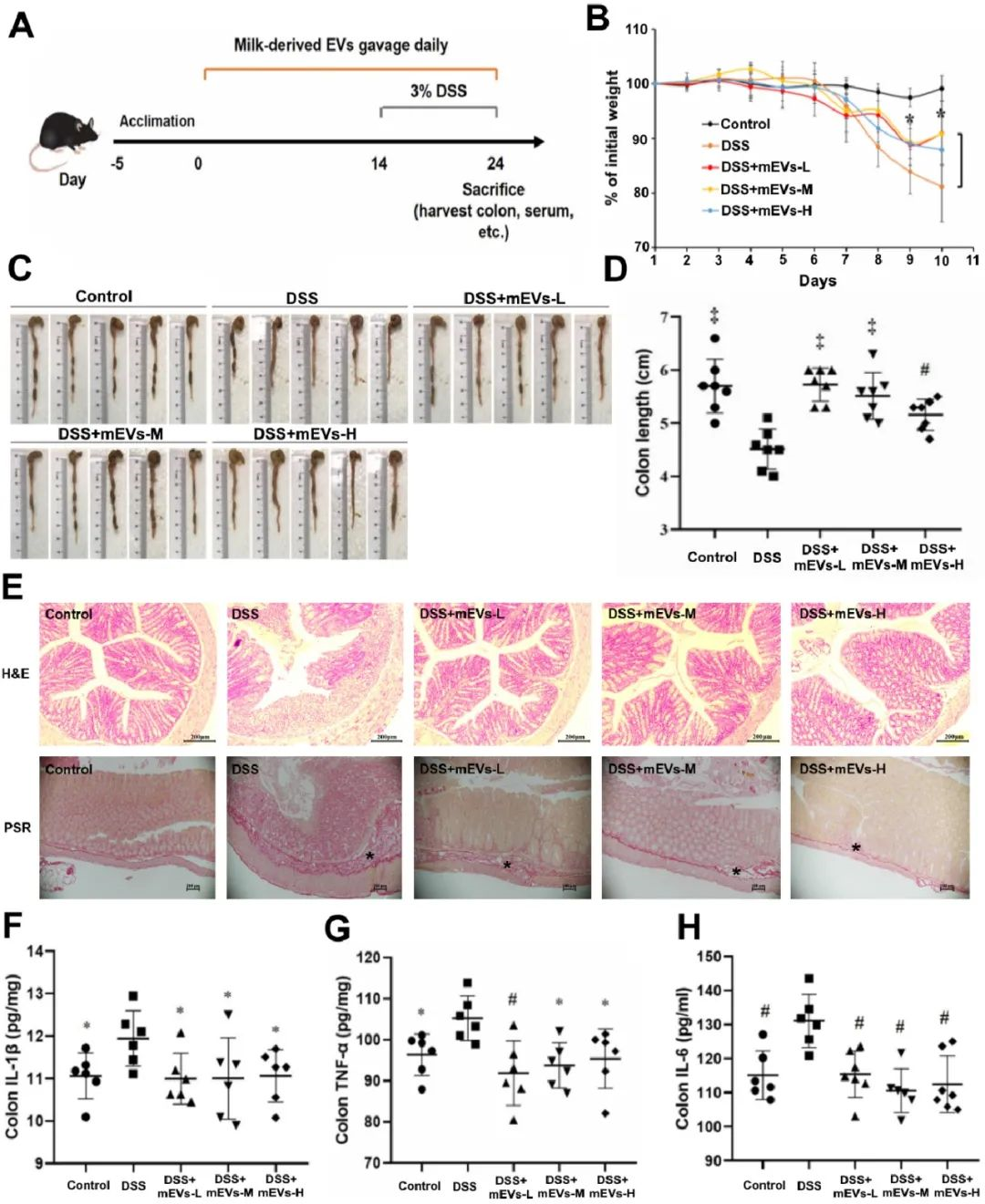
研究發(fā)現(xiàn),經(jīng)DSS處理的小鼠體重逐漸減輕;而mEVs治療顯著防止DSS誘導的潰瘍性結腸炎(UC)小鼠的體重下降和結腸長度縮短。此外,H&E和天狼猩紅染色顯示,mEVs減輕了UC小鼠腸上皮的破壞、炎癥細胞浸潤和纖維化組織的生成。細胞因子紊亂是結腸炎的主要特征之一,IBD中出現(xiàn)的促炎細胞因子和抗炎細胞因子之間的不平衡阻礙了炎癥的緩解。在DSS誘導小鼠的血清和結腸組織中觀察到多種細胞因子的顯著增加。相反,mEVs治療抑制了DSS誘導的IL-1β、TNF-α、IL-6、IL-2和IL-22的上調。此外,結腸炎癥和氧化應激的關鍵標志——髓過氧化物酶(MPO)的活性在DSS誘導的小鼠中顯著增加,然而mEVs處理抑制了DSS誘導小鼠MPO活性的升高。這些結果表明,mEVs可以通過抑制促炎細胞因子的產生來預防小鼠結腸炎。
3. mEVs在體內外的免疫調節(jié)機制
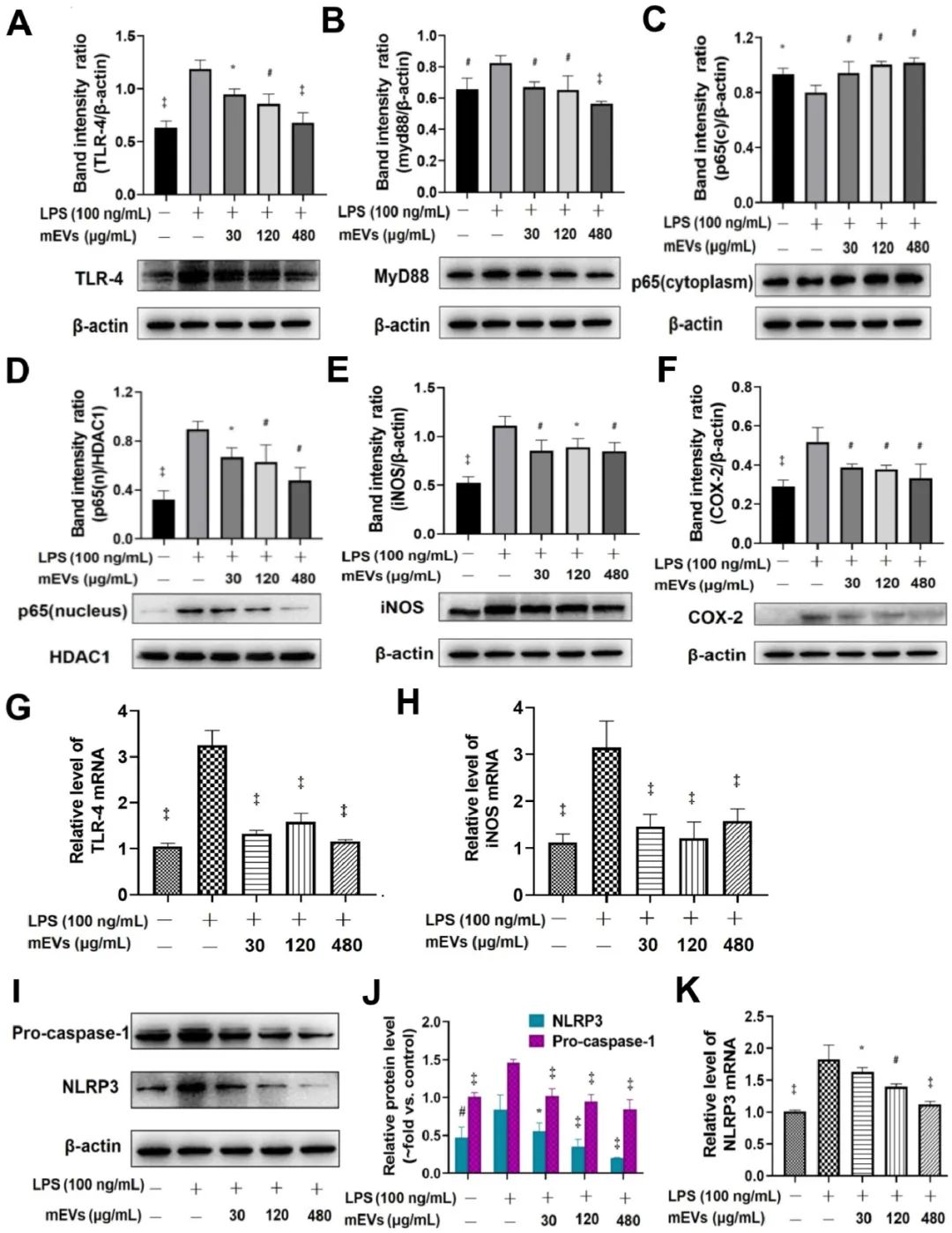
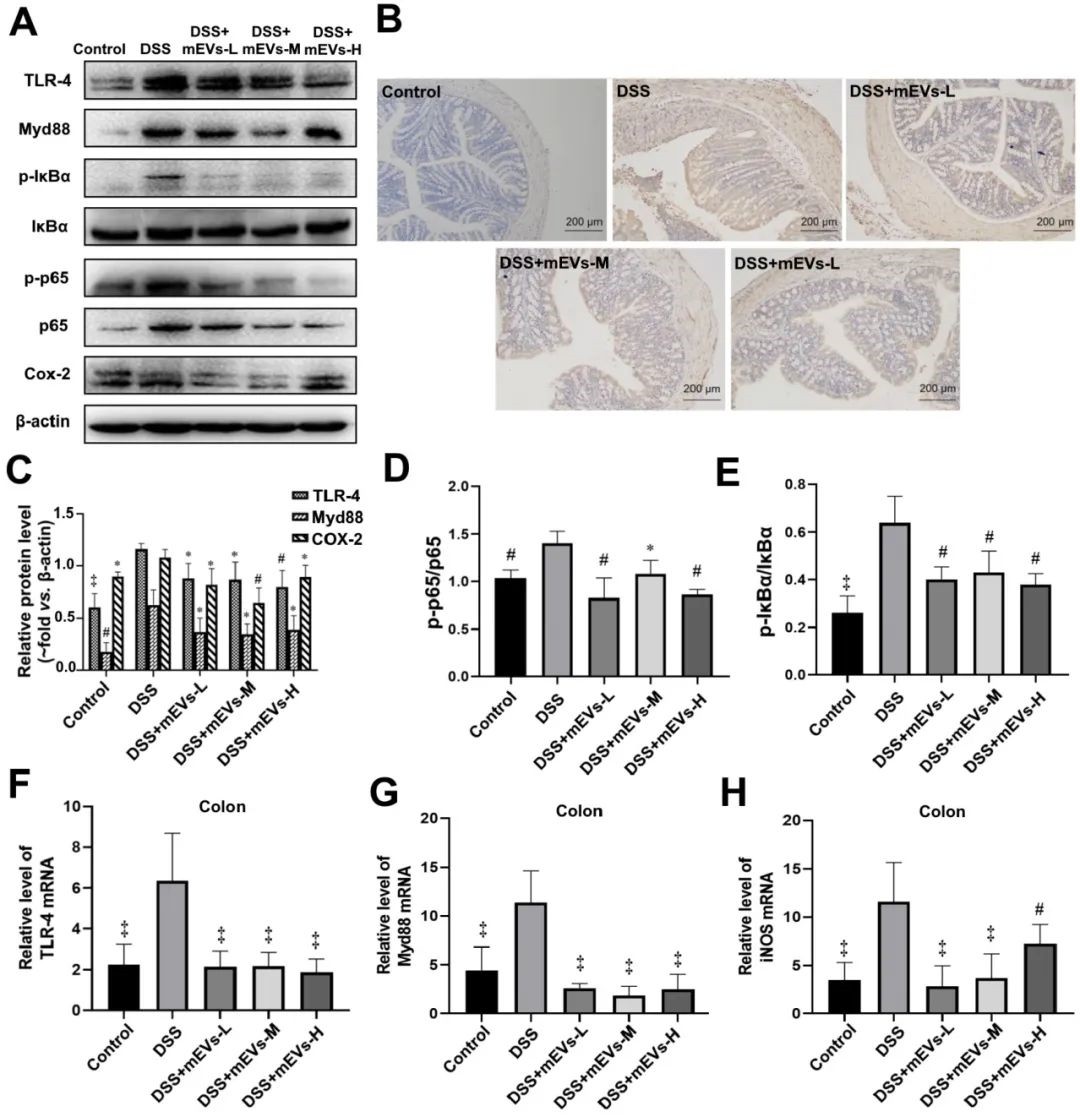
在體外和UC小鼠模型中,mEVs均可抑制TLR4-NF-κB信號通路和NLRP3信號通路介導的炎癥反應。
在模擬體外實驗中發(fā)現(xiàn),與LPS組相比,mEVs以劑量依賴性的方式下調TLR4和Myd88的蛋白水平。LPS刺激后,p65蛋白在細胞核中的表達明顯增加,在細胞質中的表達明顯減少,而mEVs則逆轉了p65在細胞核和細胞質中的細胞分布。這些結果表明,mEVs可以抑制p65向核內轉位,從而抑制NF-κB信號通路的激活。此外,NLRP3信號通路中的前caspase-1和NLRP3的表達在LPS誘導的細胞中被上調,mEVs也以劑量依賴性的方式逆轉其表達。
在小鼠模型(體內實驗)中,為了確定mEVs在DSS誘導的結腸炎模型中的免疫調節(jié)機制,本文通過western blotting、免疫組化和RT-PCR檢測TLR4-NF-κB和NLRP3信號通路中幾個關鍵調控因子的表達。在DSS處理小鼠中,TLR4、Myd88、COX2、磷酸化-IκBα和p65蛋白的表達水平顯著升高,mEVs可有效抑制TLR4-NF-κB信號通路成分的變化。同樣,mEVs處理在mRNA水平上抑制了DSS處理小鼠中TLR4、Myd88和iNOS的上調。與TLR4-NF-κB信號通路類似,在DSS誘導小鼠中,NLRP3信號通路關鍵成分,包括NLRP3、凋亡相關斑點樣蛋白(ASC)和前caspase-1的表達增加。這些結果表明,mEVs可抑制TLR4-NF-κB和NLRP3信號通路,從而預防小鼠結腸炎。
4. mEVs修復潰瘍性結腸炎腸道菌群失衡,調節(jié)腸道免疫
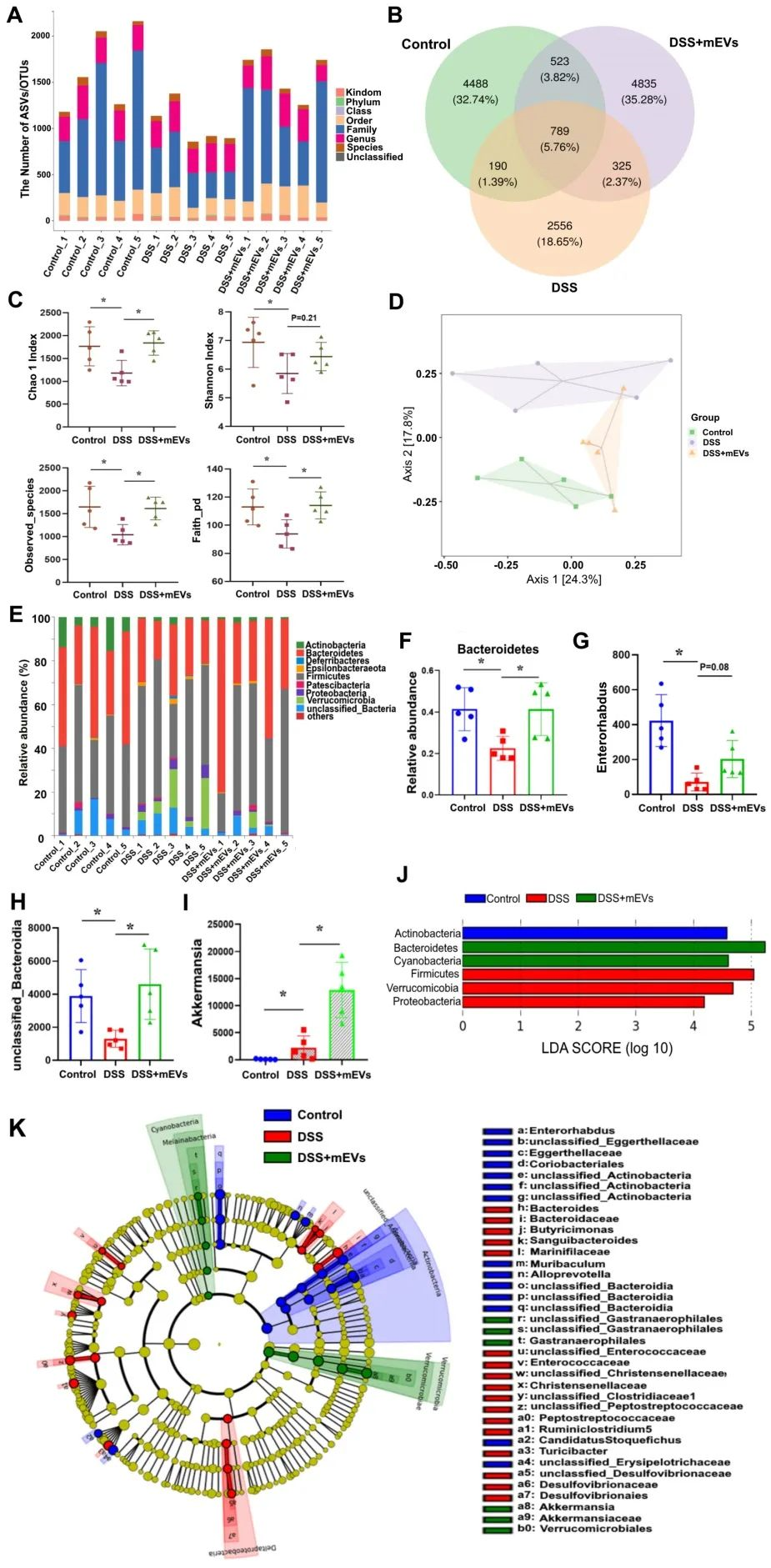
16S rRNA基因測序的結果表明,在DSS誘導的結腸炎中,腸道菌群的多樣性降低,而在mEVs處理后,多樣性適度恢復。評價腸道微生物群落豐富度和多樣性的α多樣性指數(shù),比如Chao 1指數(shù)、Shannon指數(shù)、Observed species指數(shù)和Faith_pd指數(shù)在DSS誘導下均顯著降低,而mEVs處理有效地恢復了腸道微生物群落的α多樣性。PCoA分析和物種的差異分析同樣顯示,mEVs可以重塑DSS誘導小鼠的腸道菌群,使其恢復到正常的微生物群落結構。
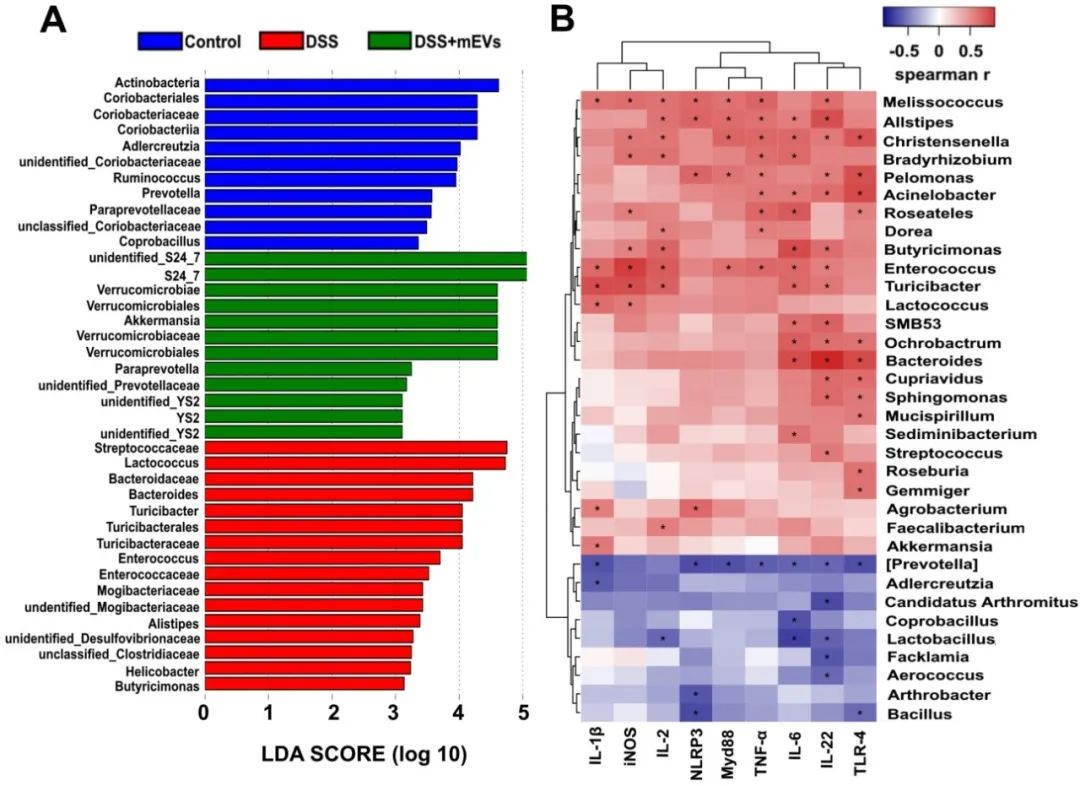
最后,為了進一步探討mEVs在結腸炎中如何調節(jié)腸道免疫和腸道菌群,本研究對腸道菌群和免疫炎癥因子進行了Spearman關聯(lián)分析。結果表明,Enterococcus、Turicibacter、Helicobacter、Desulfovibrionaceae、unclassified Desulfovibrionaceae和Mogibacteriaceae等有害細菌的增加與DSS誘導的結腸炎中促炎細胞因子和免疫炎癥通路關鍵基因的表達呈正相關;而Akkermansia、S24_7、Paraprevotella、Verrucomicrobiaceae等有益菌的減少則與這些基因的表達呈負相關,從而揭示了mEVs可通過腸道菌群調節(jié)腸道免疫穩(wěn)態(tài)來預防小鼠結腸炎。
研究總結
本文研究了mEVs對潰瘍性結腸炎的治療作用及其可能的機制,證明了mEVs含有豐富的蛋白質和microRNAs參與免疫調節(jié),并利用體外和體內炎癥模型進一步評估了mEVs對腸道免疫和腸道菌群的影響。結果表明mEVs可抑制TLR4-NF-κB信號通路和NLRP3信號通路介導的炎癥反應;口服mEVs可通過恢復腸道細胞因子穩(wěn)態(tài)、調節(jié)免疫細胞平衡以及改善腸道菌群失調等方式來共同緩解小鼠結腸炎。
更多技術資訊,請關注派森諾官網(wǎng)