
2021-07-06

期刊:Cell Death and Disease
影響因子:8.469
近期,派森諾生物與哈爾濱工業大學生命學院吳瓊老師課題組合作,在Cell Death & Disease期刊上,發表了題為《EphA2 super-enhancer promotes tumor progression by recruiting FOSL2 and TCF7L2 to activate the target gene EphA2》的文章,該文章揭示了治療多種腫瘤的潛在靶點。
研究背景
超級增強子是更大的轉錄增強子簇,在驅動腫瘤發生中發揮關鍵作用。與典型增強子相比,超級增強子的大小、轉錄因子的密度和含量以及誘導轉錄的能力各不相同。越來越多的證據表明,超級增強子在調節細胞特性、細胞命運、干細胞多能性,甚至腫瘤發生中發揮著重要的作用。超級增強子可能促進它們各自相關基因的表達,如Sox2、Gata2和成脂特異性基因。先前發表在同行評議期刊上的數據報道,超級增強子驅動癌細胞中致癌基因的高水平轉錄。然而,EphA2相關的超級增強子及其輔助因子調控其靶基因的機制尚不明確,其在癌細胞中的生物學功能也尚不清楚。本研究旨在探討一種新型超級增強子在多種腫瘤細胞中的作用及機制。
研究思路
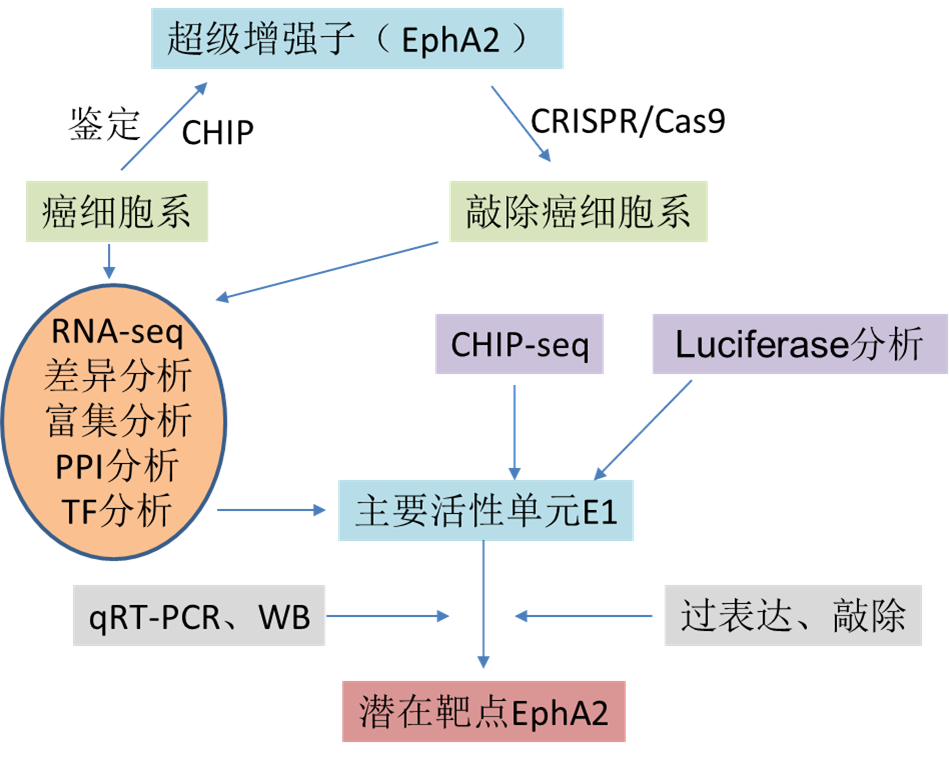
研究內容
1. 多細胞系中超級增強子的鑒定
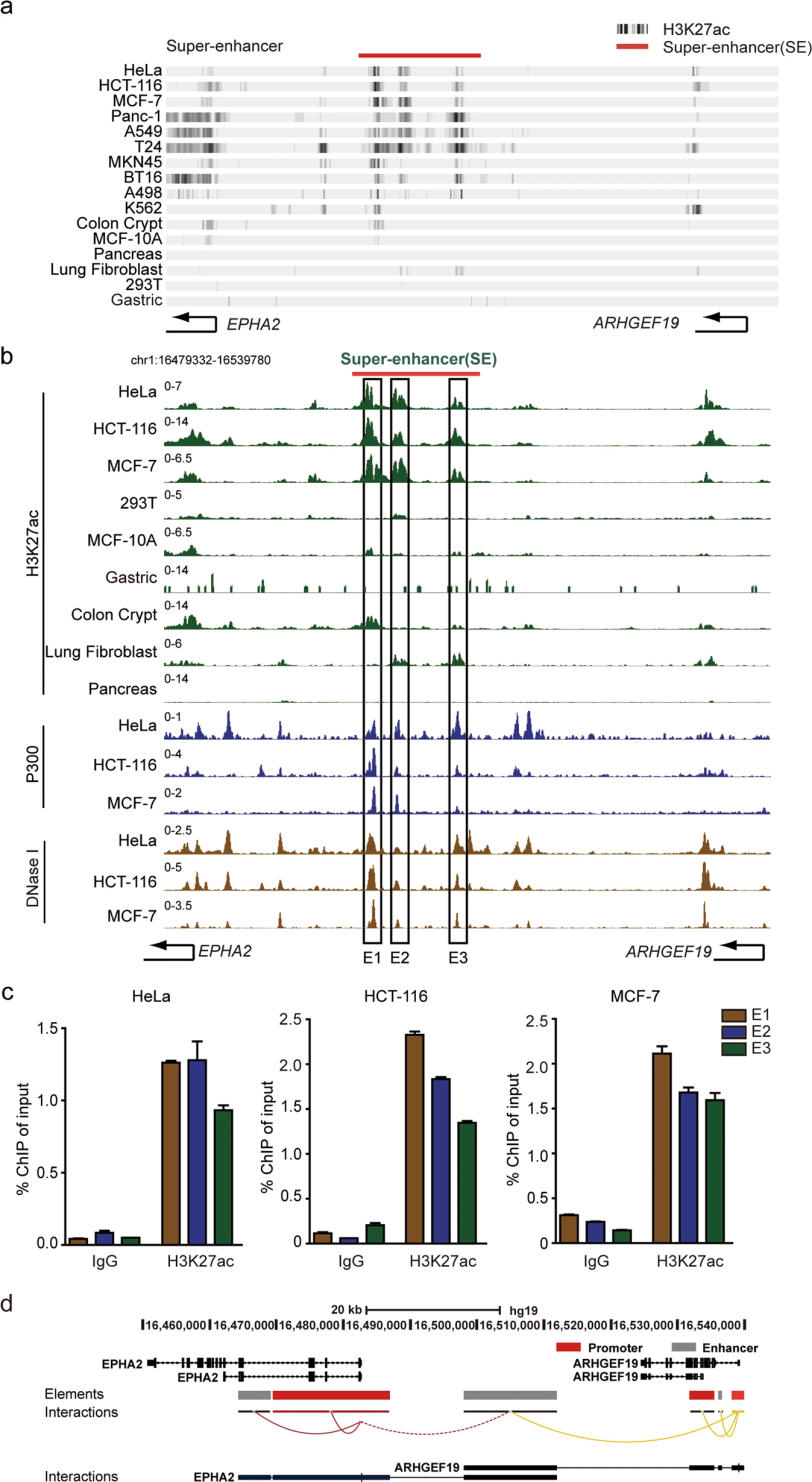
超級增強子以富集H3K27ac為特征,促進細胞身份相關基因的表達。本研究通過檢索多個數據庫,在A549、HeLa、MCF-7、HCT-116、Panc-1、T24、MKN45、BT16、A498和K562癌細胞中發現了一種超級增強子。通過Cistrome數據瀏覽器的公開H3K27ac ChIPseq數據(http://cistrome。org/db/#/),我們獲得了該超級增強子在10個腫瘤細胞中的H3K27ac富集水平。研究結果表明,超級增強子的存在在癌細胞系中富集,而在正常細胞系中普遍缺失。此外,為了進一步研究潛在的超級增強子,我們基于增強子相關特征分析了DNA的這一區域。結果表明,該區域具有較高的H3K27ac富集和P300、DNase I超敏性。據此,我們將這個超增強子進一步劃分為三個組成的增強子區域,E1-E3。使用H3K27ac抗體進行ChIP實驗,檢測超強增強子成分增強子的活性組蛋白修飾。結果顯示,H3K27ac在HeLa、MCF-7、HCT-116、A549和Panc-1細胞的每個增強子簇E1-E3上均富集。根據GeneHancer和4DGenom兩個數據庫檢索,確定的新的超級增強子被認為與兩個不同基因的啟動子相互作用,EphA2和ARHGEF19。因此,這些基因可以作為該超級增強子的候選靶基因。
2. RNA-seq分析表明,EphA2-SE的缺失顯著降低了EphA2的表達
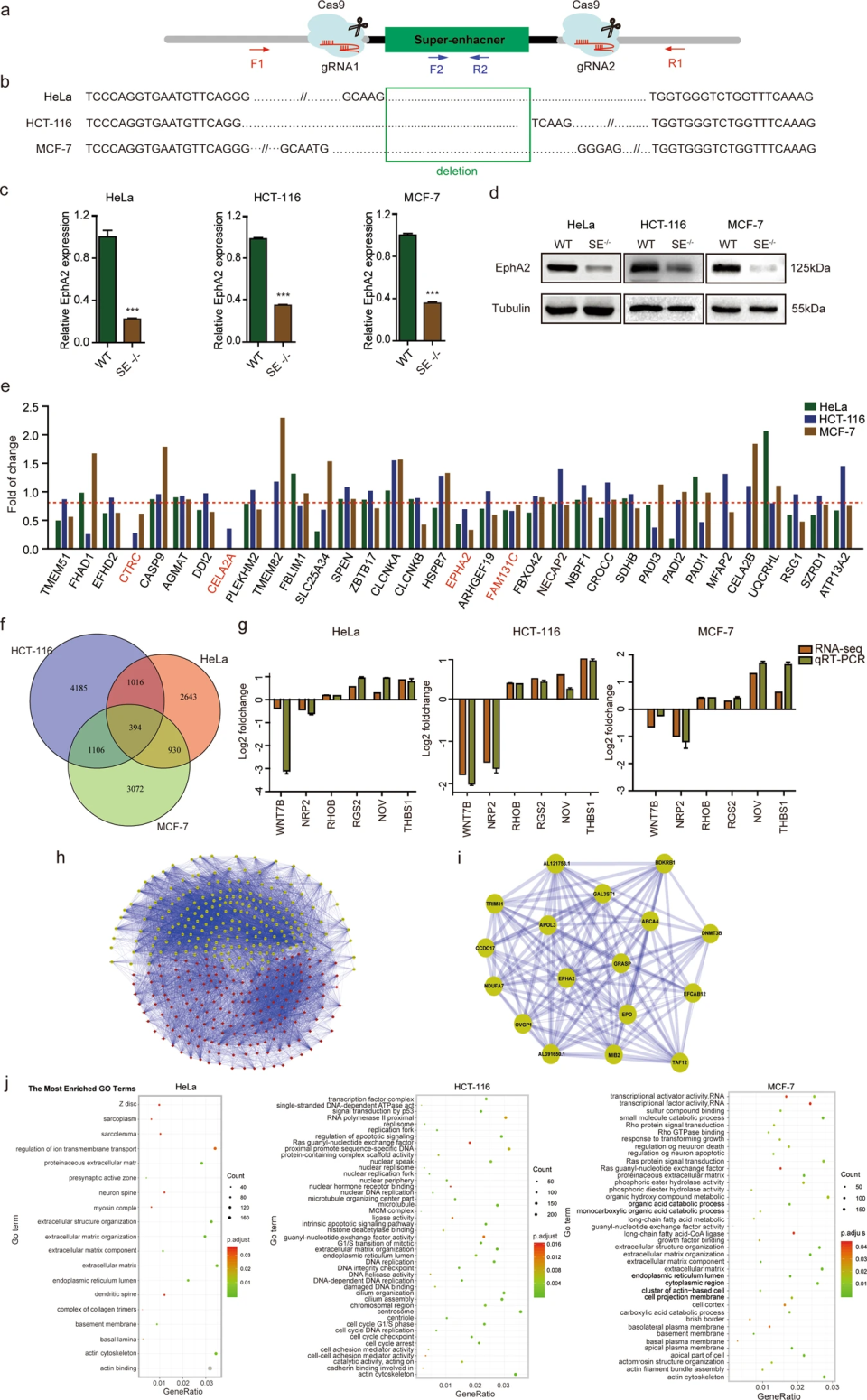
為了研究超級增強子在癌細胞中的靶基因和功能作用,我們使用CRISPR/Cas9系統特異性敲除了超級增強子并進行了靶基因和RNA-seq分析。轉染研究顯示,EphA2SE是激活HeLa、HCT-116和MCF-7細胞中EphA2表達的超級增強子。
RNA-seq分析結果表明,超級增強子調控的基因表達水平遠遠高于普通增強子調控的基因表達水平。因此,EphA2更有可能受到超級增強子的調控。在3個細胞中分別發現4983、6701和5502個差異基因,共獲得394個調控相同的共有DEGs,富集分析顯示,這些基因有許多與腫瘤生長和轉移相關。并對這些基因做了網絡圖,發現EphA2位于核心位置。對HCT-116、HeLa和MCF-7各細胞中DEGs的功能富集分析表明,EphA2-SE在腫瘤細胞的發展中起著重要作用。
3. EphA2-SE的增強子活性和信號模塊的超級增強子
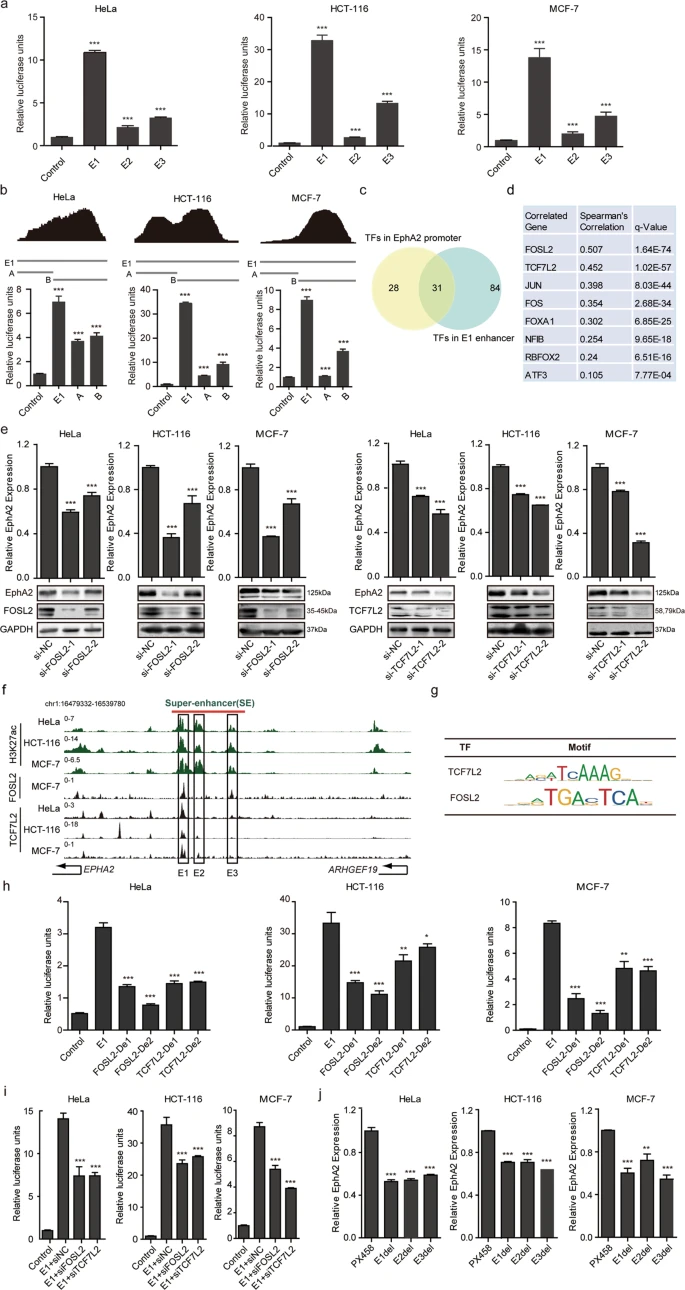
將EphA2SE的單個組分增強子E1-E3克隆到熒光素酶報告載體中,發現其活性高于對照。在HeLa、HCT-116和MCF-7細胞中,E1成分增強子產生的信號最大,其次是E3和E2增強子。另外ChIP-seq數據庫和轉錄因子富集密度分析結果都表明, E1成分增強子是EphA2-SE的主要活性單元。為了模擬細胞內染色質結構,我們刪除了HeLa、HCT-116和MCF-7細胞的三個組分部分增強子。結果顯示,E1-E3成分增強子部分缺失后,EphA2的表達明顯下調,但不同成分間差異不大。
4. EphA2- se缺失通過降低EphA2在體外的表達來抑制細胞的增殖、遷移和侵襲
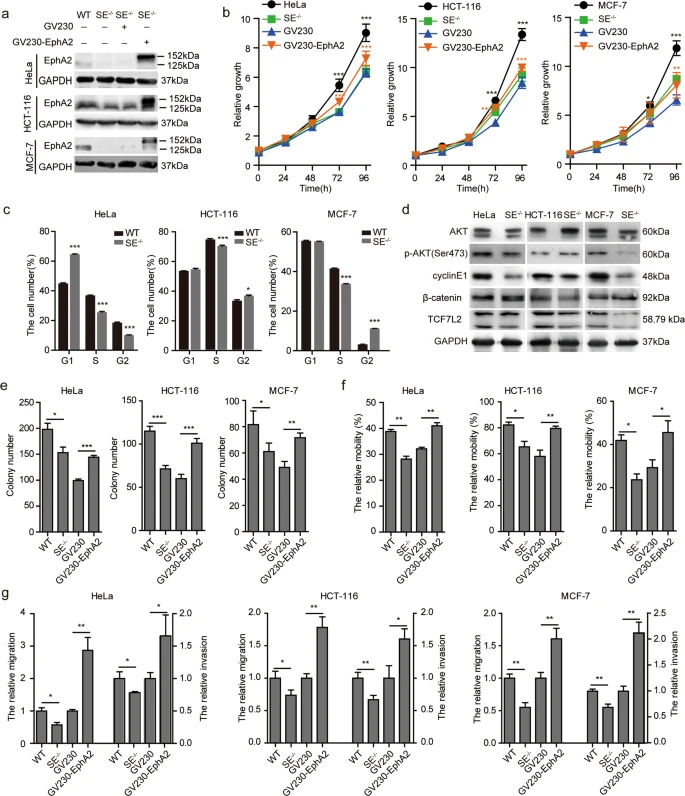
許多由超級增強子調控的致癌基因在腫瘤中以異常高的水平表達。我們在HeLa、HCT-116和MCF-7細胞中過表達EphA2。結果顯示,EphA2- se缺失顯著抑制了細胞的生長,而過表達EphA2挽救了EphA2SE缺失導致的緩慢增殖。EphA2-SE敲除導致細胞周期阻滯G1/S期或G2/M期,與細胞增殖結果一致。前期研究表明EphA2與p-AKT相關,而TCF7L2是WNT/β-catenin信號通路下游的關鍵轉錄因子。因此我們檢測了PI3K/AKT和WNT/β-catenin,結果顯示,EphA2-SE在不同的腫瘤細胞中激活不同的信號通路。在HeLa、HCT-116和MCF-7細胞中,EphA2SE缺失顯著抑制細胞遷移和侵襲,過表達EphA2促進細胞遷移和侵襲。這說明EphA2-se缺失導致EphA2表達降低,顯著抑制HeLa、HCT-116和MCF-7癌細胞的增殖、遷移和侵襲。
5. EphA2-SE缺失抑制體內腫瘤發生和腫瘤增殖
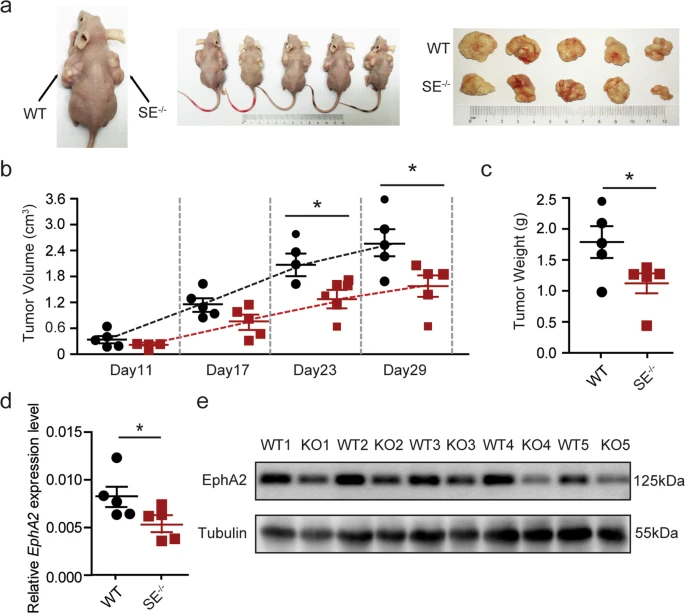
為了進一步探討EphA2-SE在體內對腫瘤發生的影響,將EphA2-SE缺失純合子HeLa細胞和對照細胞注射到裸鼠側翼。從細胞移植后第11天開始,每隔6天測量腫瘤直徑。與注射對照細胞形成的腫瘤相比,EphA2敲除細胞形成的腫瘤在體積和重量上都要小得多(圖5a-c)。我們采用qRT-PCR和western blotting檢測EphA2-SE對其目的基因表達的影響。如圖5d-e所示,敲除EphA2- se顯著下調了EphA2的表達。綜上所述,EphA2- se缺失可能通過調控EphA2在體內外的表達來抑制HeLa細胞的增殖和生長。
總 結
siRNA介導的FOSL2和TCF7L2下調也導致了E1活性的降低。用CRISPR/Cas9敲除3個細胞中E1-E3組分增強子后,靶基因EphA2的表達明顯下調。MTT和細胞周期分析表明,EphA2-SE的缺失通過阻斷PI3K/AKT和WNT/β-catenin信號通路抑制癌細胞增殖。在體內,EphA2-SE的缺失抑制了HeLa細胞的生長,EphA2表達下調。綜上所述,FOSL2和TCF7L2結合E1成分增強子的不同位置,共同調控EphA2的表達,從而誘導HeLa、HCT-116和MCF-7細胞的增殖和侵襲。
總之,本研究在10個癌細胞系中發現了一個新的EphA2相關超級增強子。結果表明,在癌細胞中,EphA2- se通過核心成分E1招募TCF7L2和FOSL2,直接靶向EphA2,促進腫瘤進展。移植小鼠模型和體外細胞實驗表明,EphA2-SE的缺失減緩了腫瘤的進展。因此,EphA2-SE是治療多種腫瘤的潛在靶點。
注:本文中轉錄組建庫測序和分析內容由派森諾生物科技有限公司完成。