
2021-04-14

期刊:Nature Communications
影響因子:12.121
近期,派森諾生物與復旦大學基礎醫學院合作,在Nature子刊Nature communications上,發表了題為《β-arrestin 2 as an activator of cGAS-STING
signaling and target of viral immune evasion》的文章,該文章揭示了病毒免疫逃逸的新機制,影響因子12.121分。
研究背景
病毒是威脅人類健康的世界性問題,造成巨大的經濟損失和社會問題。人體免疫反應包括固有免疫和適應性免疫。固有免疫作為免疫反應的第一線,是通過一套模式識別受體(PRRs)識別病原體相關分子模式(PAMPs)而激活的,PAMPs隨后可調節適應性免疫,共同消滅病毒。
固有免疫抗病毒主要發揮作用的是Ⅰ型干擾素及其調控的信號通路。IFNβ可以激活JAK-STAT通路,促進TNFα、IL-6等大量炎癥因子的表達,從而啟動機體抗病毒免疫反應。
該文章研究結果表明,β-arrestin 2通過cGAS調節Ⅰ型干擾素通路的分子機制,而病毒通過降解β-arrestin 2實現其免疫逃逸的目的。
研究思路
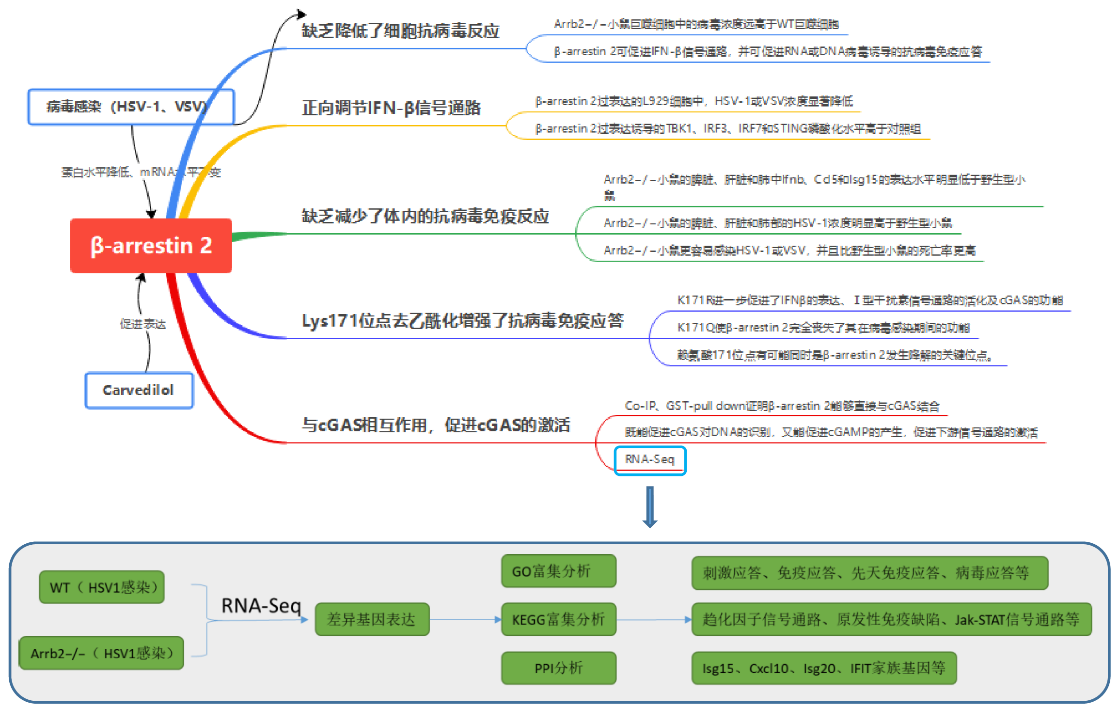
研究內容
1、β-arrestin 2的缺乏降低了細胞抗病毒反應
β-抑制素2的缺乏降低了細胞抗病毒反應
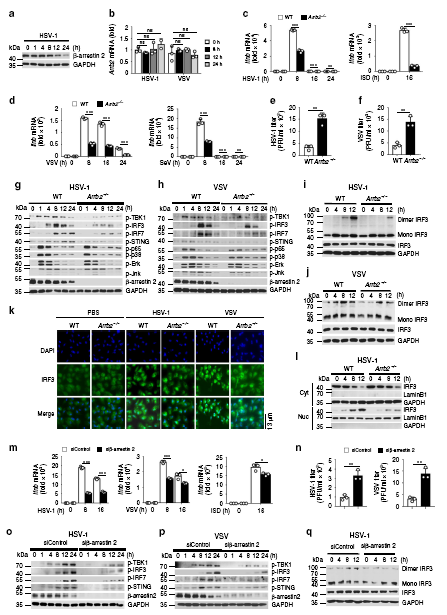
HSV-1、VSV病毒感染后,β-arrestin 2蛋白水平降低,而mRNA表達豐度不受病毒感染的影響,這表明β-arrestin 2可能在翻譯后被病毒降解。病毒感染后,Arrb2?/?小鼠巨噬細胞中的病毒濃度遠高于WT巨噬細胞。信號傳導通路關鍵基因含量檢測等實驗結果顯示,β-arrestin 2可促進IFN-β信號通路,并可促進RNA或DNA病毒誘導的抗病毒免疫應答。
2、β-arrestin 2正向調節IFN-β信號通路
β-arrestin 2正向調節IFN-β信號通路
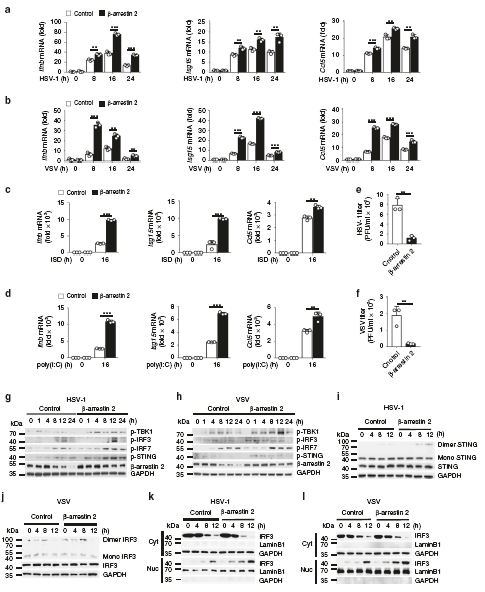
接下來,為了研究β-arrestin 2過表達是否對IFN-β信號通路有實質性影響,作者做了過表達實驗。我們觀察到,在β-arrestin 2過表達的L929細胞中,HSV-1或VSV濃度降低。而L929細胞中β-arrestin 2過表達誘導的TBK1、IRF3、IRF7和STING磷酸化水平高于對照組。異位β-arrestin 2表達的細胞在HSV-1或VSV刺激后,STING二聚化和IRF3二聚化顯著升高,IRF3移位到細胞核。這些結果表明,β-arrestin 2通過促進STING和IRF3二聚體的形成,增強了IRF3從細胞質向核的轉運和IFN-β信號轉導。
3、 β-arrestin 2的缺乏減少了體內的抗病毒免疫反應
β-arrestin 2的缺乏減少了體內的抗病毒免疫反應
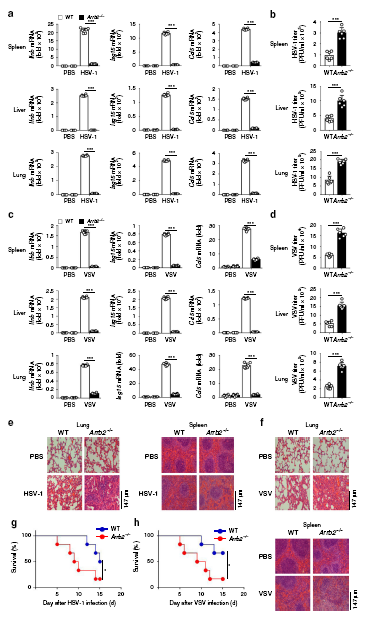
為了研究β-arrestin 2在體內抗病毒先天免疫應答中的作用,我們用HSV-1或VSV感染6周齡純合子Arrb2?/?小鼠和野生型Arrb2?/?小鼠,并評估Ifnb、Isg15和Ccl5在不同組織中的表達水平。用HSV-1感染小鼠后,Arrb2?/?小鼠的脾臟、肝臟和肺中Ifnb、Ccl5和Isg15的表達水平明顯低于野生型小鼠。與此結果一致的是,我們觀察到Arrb2?/?小鼠的脾臟、肝臟和肺部的HSV-1濃度明顯高于野生型小鼠。當使用VSV作為刺激時,也得到了類似的結果。與這些結果一致的是,我們觀察到Arrb2?/?小鼠的肺和脾臟損傷比WT小鼠更多。我們進一步比較了野生型和Arrb2?/?小鼠在感染HSV-1或VSV后的存活率,發現Arrb2?/?小鼠更容易感染HSV-1或VSV,并且比野生型小鼠的死亡率更高。
所有這些體內實驗結果都表明,β-arrestin 2是一種關鍵的對RNA和DNA病毒的抗病毒免疫應答的正向調節因子。
4、β-arrestin 2與cGAS相互作用,促進cGAS的激活
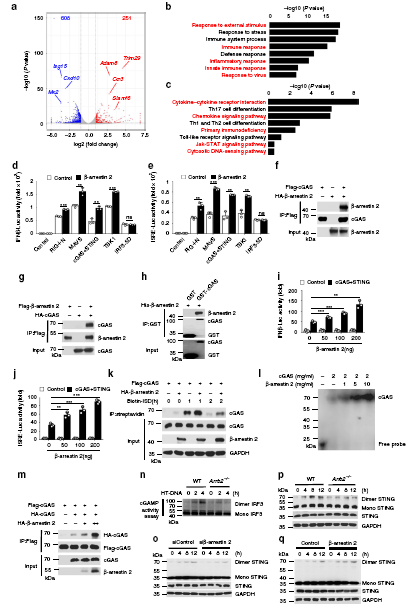
β-arrestin 2與cGAS相互作用,促進cGAS的激活
為了進一步研究β-arrestin 2在宿主抗病毒免疫中對病毒感染的作用,我們對HSV1感染的WT和Arrb2?/?進行了RNA-seq分析。與WT組相比,Arrb2?/?有859個基因的表達量發送顯著變化(251個上調,608個下調)。基于差異基因的PPI分析顯示,宿主抗病毒基因之間存在密切的相互作用網絡,如Isg15、Cxcl10、Isg20、IFIT家族基因等。
GO富集分析顯示,Arrb2?/?組下調了與外界刺激應答、免疫應答、炎癥應答、先天免疫應答、病毒應答等相關的多個基因的表達。同樣,KEGG富集分析顯示在細胞因子-細胞因子受體相互作用、趨化因子信號通路、原發性免疫缺陷、Jak-STAT信號通路、胞質DNA傳感通路等方面差異基因富集顯著。
且研究者通過免疫共沉淀及GST-pull down實驗發現,β-arrestin 2能夠直接與cGAS結合。cGAS作為信號感受器,在病毒感染期間,能夠識別雙鏈DNA使得自身構象發生改變,從而促進AMP和GMP合成為cGAMP,而cGAMP能夠被STING識別,從而激活下游信號通路。研究者們發現β-arrestin 2既能促進cGAS對DNA的識別,又能促進cGAMP的產生,促進下游信號通路的激活。
5、β-arrestin 2的Lys171位點去乙酰化增強了抗病毒免疫應答
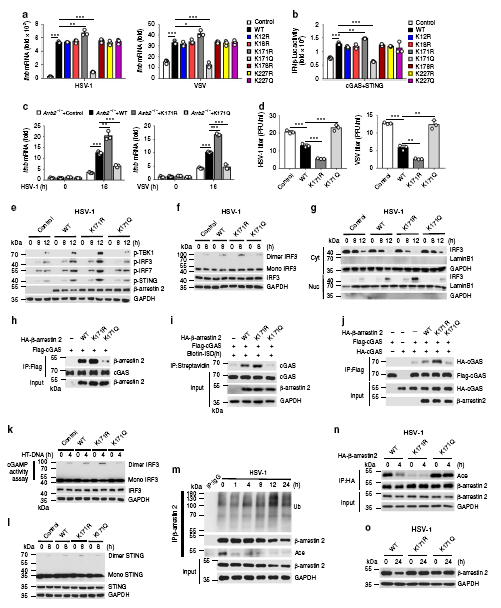
β-arrestin 2的Lys171位點去乙酰化增強了抗病毒免疫應答
研究表明,病毒感染能夠降解β-arrestin 2。且研究者通過質譜篩選得到了一個結合關鍵位點賴氨酸171(Lys171)。研究者構建了兩種點突變K171R(不發生乙酰化也不發生泛素化)和K171Q(模擬持續性乙酰化狀態)來研究乙酰化和泛素化對β-arrestin 2功能的影響,結果顯示,β-arrestin 2賴氨酸171位點的去乙酰化是其發揮功能的先決條件。且有另外的研究顯示,β-arrestin 2的點突變K171R和K171Q在感染期間均不發生降解,這說明賴氨酸171位點有可能同時是β-arrestin 2發生降解的關鍵位點。
6、卡維地洛通過β-arrestin 2促進抗病毒免疫
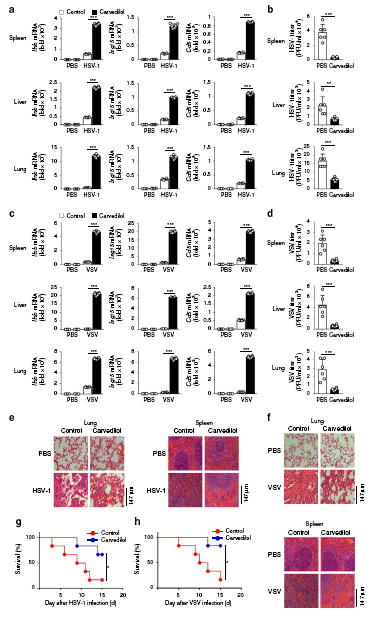
卡維地洛促進體內抗病毒免疫
有研究表明,卡維地洛(Carvedilol)作為β受體阻斷劑,可增加大鼠急性心肌梗死模型中β-抑制素2的表達,調節β1AR信號。作者據此將其運用到病毒感染模型中,發現Carvedilol能夠促進Ⅰ型干擾素信號通路的活化和小鼠的抗病毒免疫,然而其在β-arrestin 2缺失的細胞和小鼠中失去了相應的功能。因此,卡維地洛通過阻止β-arrestin 2的降解和促進β-arrestin 2的Lys171去乙酰化,正向調節IFN-β信號通路和抗病毒免疫。這提示,卡維地洛(Carvedilol)在將來有可能成為有效的抗病毒藥物,當然這還需要進一步的研究及臨床數據的支持。
總結
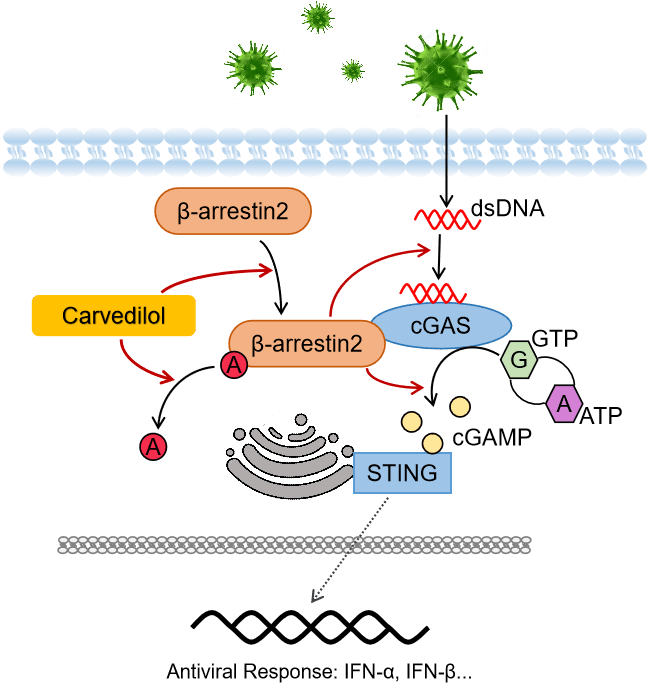
研究結果表明,β-arrestin 2與cGAS直接結合并促進cGAS和DNA的結合及cGAMP的產生,而β-arrestin 2在感染中發生的去乙酰化是其發揮抗感染功能的基礎。在病毒感染早期,β-arrestin 2迅速發生去乙酰化而活化,發揮其抗感染功能;而在感染晚期,β-arrestin 2卻能被病毒誘導,發生泛素化而被降解,幫助病毒實現免疫逃逸。
進一步的研究發現,抗心衰藥物Carvedilol能夠促進β-arrestin 2的去乙酰化及抑制β-arrestin 2的降解,通過穩定β-arrestin 2調控Ⅰ型干擾素信號通路及小鼠的抗病毒免疫,提示其可作為潛在的抗病毒藥物。
本研究的轉錄組測序和數據分析工作由上海派森諾生物科技有限公司完成。
原文索引:
Zhang Y, Li M, Li L, Qian G, Wang Y, Chen Z, Liu J, Fang C, Huang F, Guo D, Zou Q, Chu Y, Yan D. β-arrestin 2 as an activator of cGAS-STING signaling and target of viral immune evasion. Nat Commun. 2020 Nov 26;11(1):6000. doi: 10.1038/s41467-020-19849-9. PMID: 33243993; PMCID: PMC7691508.