
2019-12-10

染色質結構在基因表達調控中起著關鍵作用。順式元件的轉錄因子(TF)結合常與染色質可接近區域有關。因此,在整個基因組中識別這些可接近區域的能力將促進對TF結合、染色質狀態和基因表達調控之間關系的理解。轉座子可及染色質測序(ATAC-seq)逐漸被應用于繪制動物基因組中開放染色質區,系統性識別動物基因組中的順式調控區和DNA足跡等。
文章題目: ATAC-Seq analysis reveals a widespread decrease of chromatin accessibility in age-related macular degeneration
發表期刊:Nature Communications
發表年份:2018
影響因子:11.878
技術手段:ATAC-Seq、RNA-seq
老年性黃斑變性(AMD)是60歲以上人群中常見的不可逆視力損害,患者隨著全球人口老齡化逐年增加。該病的早期特征會出現玻璃膜疣,視網膜色素上皮(RPE)色素異常,進行性感光功能障礙等。現代醫學技術對于占90%AMD病例的萎縮干性AMD,沒有任何有效的治療方法。目前,GWAS分析已經鑒定出至少34個AMD基因風險位點,然而,這些基因變異只解釋了AMD病例的一部分。事實上,吸煙和肥胖等變量在AMD發病中也起著非常重要的作用。該研究對較少報道的干性AMD進行全基因組染色質可及性(ATAC-seq)研究,觀察與AMD發病和發展相關的染色質可及性情況。
1、對患者和對照組的視網膜和視網膜色素上皮組織進行ATAC-seq;
2、差異開放區域(DARs)富集分析;
3、RNA-seq獲取差異表達基因;
4、DARs與差異表達基因的調控網絡分析;
5、差異開放區域(DARs)的SNPs分析;
1、視網膜和視網膜色素上皮細胞(RPE)染色質可及性情況
在這項研究中,共獲得19個正常、9個早期干性AMD和17個晚期萎縮AMD樣本。使用轉座可及染色質測序法(ATAC-Seq)來檢測基因組染色質可及性。在所有視網膜樣本中識別出78795個高置信度開放染色質區域(或峰),在所有RPE樣本中識別出49217個峰。視網膜中的染色質可及性總體上高于視網膜色素上皮,這可能反映了視網膜中細胞類型相對于視網膜色素上皮的顯示出更高的多樣性(圖1a)。同時,也揭示了視網膜和RPE共有特有的峰值類別(圖1b)。總的來說,視網膜和RPE共有39394個ATAC-Seq峰(42.0%),38625個(41.1%)是視網膜特異性峰,15844個(16.9%)是RPE特異性峰(圖1c)。在視網膜和RPE共有的絕大多數峰(81.7%)也存在于其他組織中(圖1c)。多維標度計算(MDS)分析表明,視網膜和視網膜色素上皮染色質可及性分組明顯(圖1d)。此外,大多數AMD樣本與正常樣本明顯分離,尤其是RPE,這表明健康組織與AMD組織在染色質可及性方面存在很大差異。
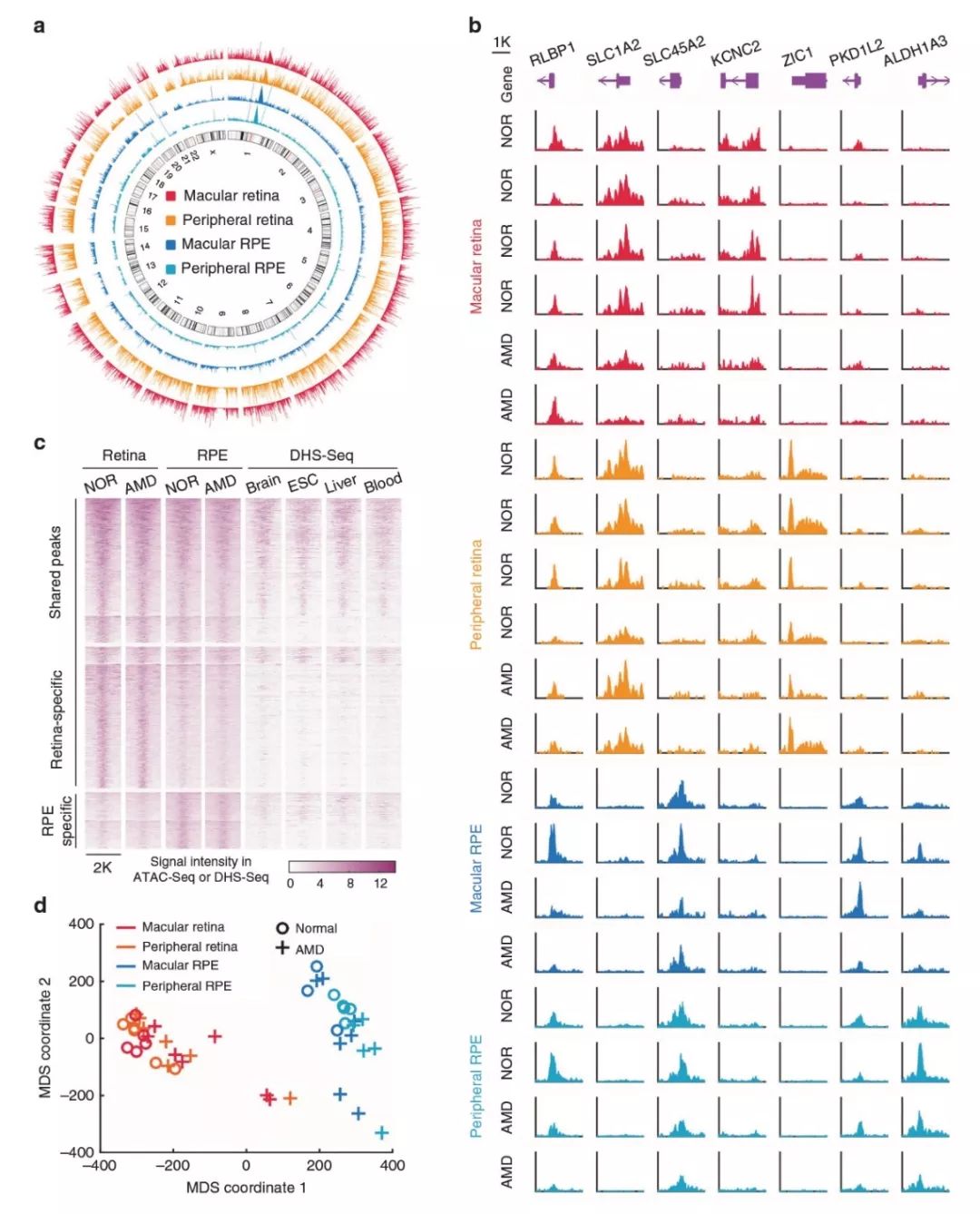
圖1 人視網膜和視網膜色素上皮細胞(RPE)染色質可及性情況
2、AMD患者染色質可及性普遍降低
在比較可及性輪廓時,發現正常和AMD視網膜樣本之間的峰值信號存在顯著的差異。例如,在視紫紅質基因RHO的三個已知調控區中,染色質可及性從正常到早期逐漸降低,然后到晚期AMD(P<0.05,圖2a)。通過比較來自黃斑和外周視網膜的健康和AMD樣本中每個峰的信號,發現72689個峰(92.3%)降低了AMD患者的染色質可及性(圖2b)。排除潛在的遺傳和環境差異的影響,從AMD狀態不對稱的眼睛(圖2c)分析,發現與患病程度較輕的眼睛相比,較嚴重的眼睛黃斑視網膜的大量峰值(76.7%)的強度降低(圖2d)。對于雙眼處于同一疾病階段的供體,其黃斑視網膜的染色質可及性輪廓高度對稱(圖2e)。這項分析證實,染色質可及性的廣泛下降與AMD的進展有關。在所有AMD患者RPE樣品中,91.6%的峰顯示AMD相對于正常樣品的強度降低(圖3a)。不同階段AMD患者的RPE中,較嚴重的左眼(圖3b)42860(87.1%)峰值的強度降低。相反,當供體的兩只眼睛處于同一疾病階段時,觀察到一個對稱分布。綜上所述,數據顯示AMD患者視網膜和RPE的染色質可及性普遍下降。
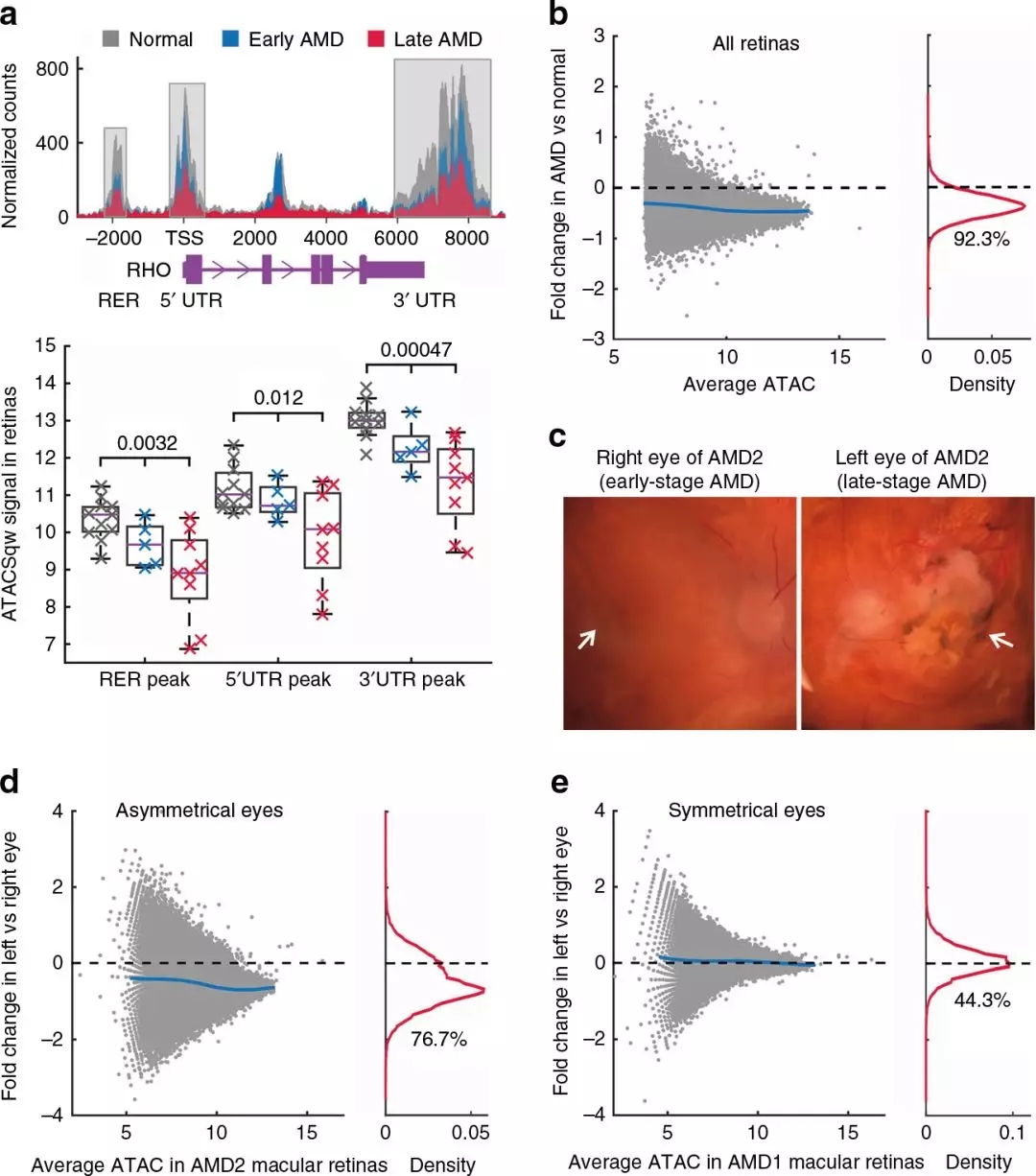
圖2 AMD視網膜染色質可及性的變化
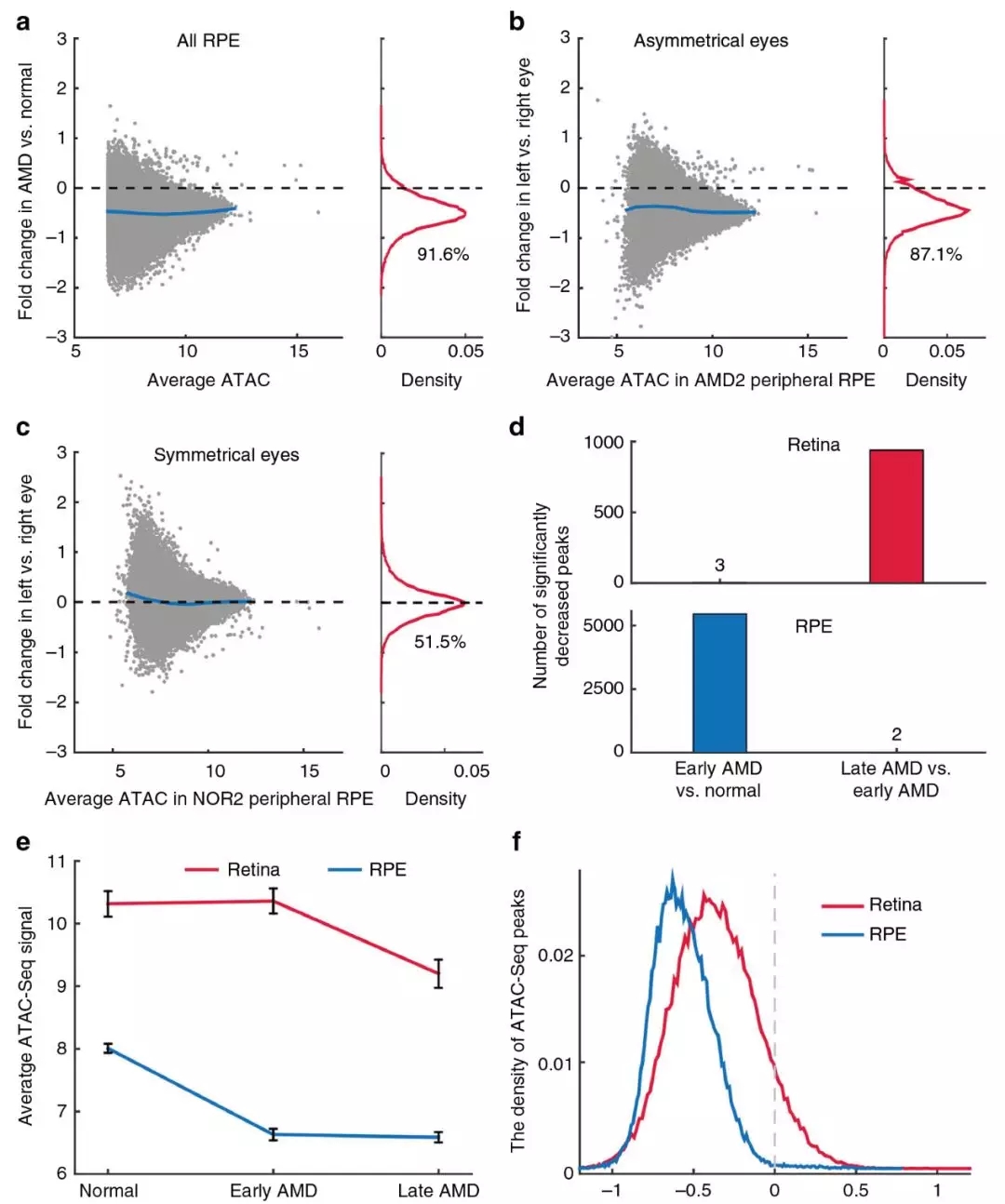
圖3 RPE和不同患病階段染色質可及性的變化
3、AMD不同階段染色質可及性降低
將早期AMD的視網膜樣本與健康對照組的視網膜樣本進行比較時,觀察到3個峰值強度在統計學上顯著降低(圖3d)。然而,通過比較晚期AMD視網膜樣本和早期AMD視網膜樣本,觀察到939個峰值,其強度顯著降低,提示視網膜染色質可及性變化主要發生在疾病晚期。相比之下,將早期AMD的RPE樣本與健康對照組的RPE樣本進行比較時,觀察到5458個顯著降低的峰,但是當相同的早期樣本與晚期AMD的RPE樣本進行比較時,只觀察到2個顯著降低的峰(圖3d)。同樣,當平均AMD任何階段顯著降低峰值的強度時,發現RPE的染色質可及性在疾病早期階段明顯低于視網膜(圖3e)。這一觀察結果符合廣泛接受的RPE功能改變觸發AMD 的理論,并提示RPE細胞的表觀遺傳改變可能是調節疾病發病的關鍵因素。
4、AMD與基因調控網絡的改變有關
為了確定正常和AMD樣本中的差異可及區(DARs)的功能,發現視網膜DARs在基因間區富集,相反,RPE-DARs富集到啟動子區域。通過檢查轉錄因子(TF)結合是否在視網膜/RPE中受到影響,觀察到22個和13個TF分別在視網膜和RPE-DARs中強烈富集(圖4)。此外,OTX2顯示晚期AMD與正常樣本相比,DARs中的足跡顯著減少(圖4b,c)。這一模式證實了AMD患者視網膜組織中OTX2靶點的染色質可及性降低,提示視網膜與RPE特異性TFs結合的靶點減少在AMD發病中起著關鍵作用。
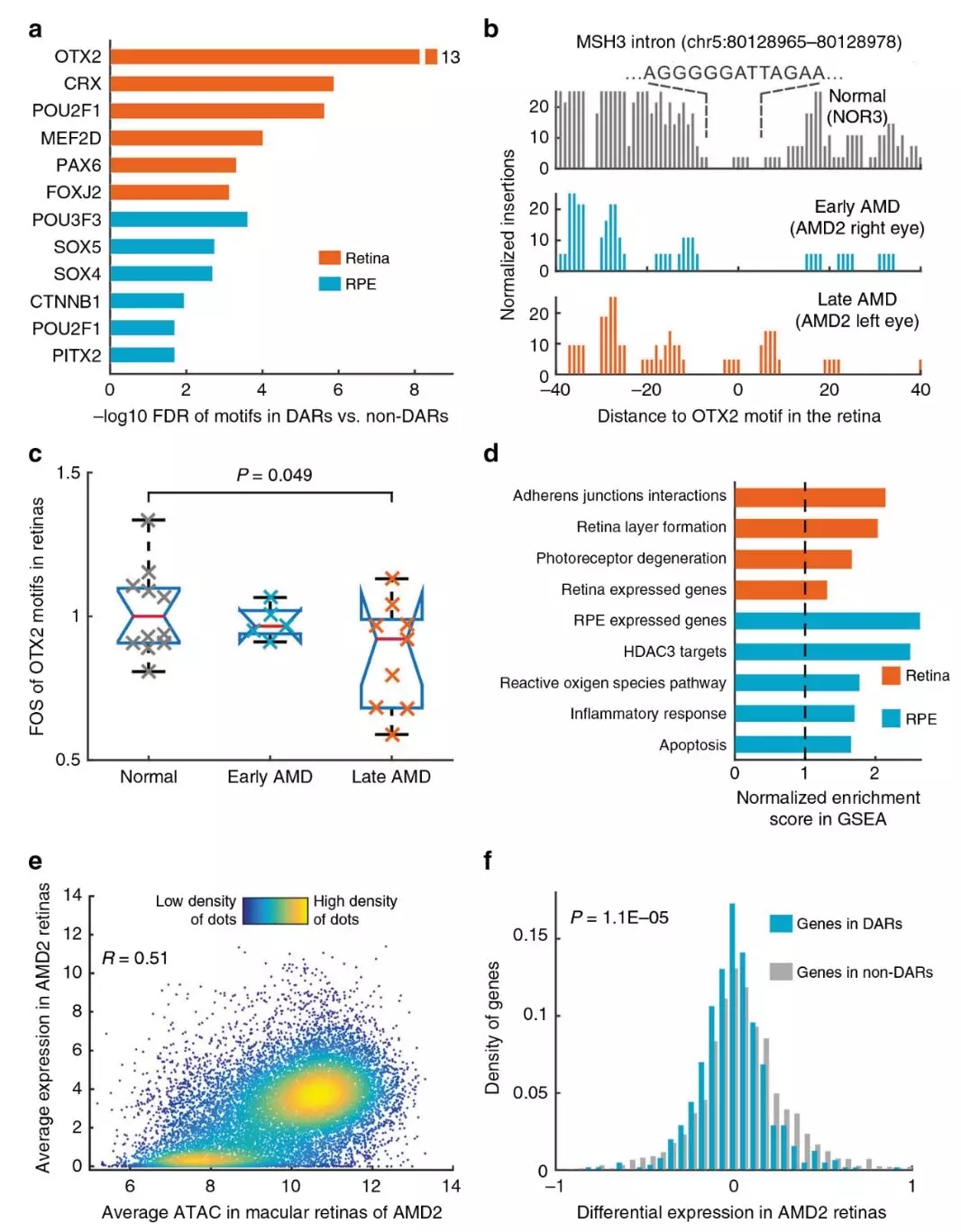
圖4 視網膜和視網膜色素上皮細胞中與DARs相關的調控和表達
5、DARs基因在AMD中表達改變
視網膜和RPE中的DAR相關基因對于在每個組織中選擇性表達的基因高度富集(圖4d)。此外,視網膜中的DAR相關基因更可能調節視網膜層的分層和感光細胞的存活,而RPE中的DAR相關基因更可能調節炎癥反應和凋亡,這是AMD的重要生物學過程(圖4d)。利用從眼睛間不同AMD階段患者獲得的RNA-Seq數據,觀察到ATAC-Seq峰值強度與視網膜和RPE中的基因表達高度相關(圖4e)。在不對稱AMD階段的患者中,DAR相關基因在晚期較早期AMD更可能被下調(P=1.1×10-5,圖4f)。結果表明,改變視網膜結合部位的染色質可及性和富含色素的TFs導致AMD相關基因的表達減少。
6、與AMD相關基因變異的關系
為了檢驗所觀察到的染色質可及性的變化是否是由AMD相關基因變異引起的,通過GWAS分析比較了DARs與AMD易感性相關基因變異的分布。發現很少的AMD相關的SNP在基因組位置被DARs覆蓋。視網膜中有<0.1%的DARs,RPE中有<0.2%的DARs,與AMD相關的SNP重疊(補充圖6e)。即使在DARs的每個方向上擴展一個5kb的窗口,DARs與AMD相關SNP重疊的比例仍然很低(視網膜<0.3%,RPE<0.4%)。為了進行比較,檢查與AMD相關的SNP重疊的非DARs和非峰的部分,并且發現重疊與視網膜和RPE中DAR區域的重疊相似。這些數據暗示,由于局部AMD相關的遺傳變異,觀察到的染色質可及性差異不大可能。
7、香煙煙霧對染色質可及性的影響
為了測試吸煙處理的人RPE細胞是否能觸發AMD樣本染色質可及性的類似變化,對培養的RPE細胞中進行RNA-Seq,證實,iPSC衍生的RPE細胞在基因表達譜上與正常RPE細胞非常相似(R=0.81)。此外,對培養的RPE細胞進行ATAC-Seq,顯示出與RPE組織中所有健康樣本的平均ATAC-Seq分布大致相似的峰值分布模式(R=0.83)。這些分析都證明了iPSC衍生RPE細胞相對于正常RPE細胞的保真度。將iPSC衍生RPE細胞暴露于香煙煙霧提取物中,并在煙霧處理前后進行ATAC-Seq分析。處理后RPE細胞染色質可及性整體下降(圖5b)。更重要的是,當比較吸煙處理過的iPSC衍生RPE細胞和AMD患者RPE細胞時,發現染色質可及性的變化高度相關(圖5c;R=0.36,P<10-20)。這些結果表明,在RPE細胞中吸煙會導致染色質可及性的廣泛降低,這與AMD中的情況非常相似。
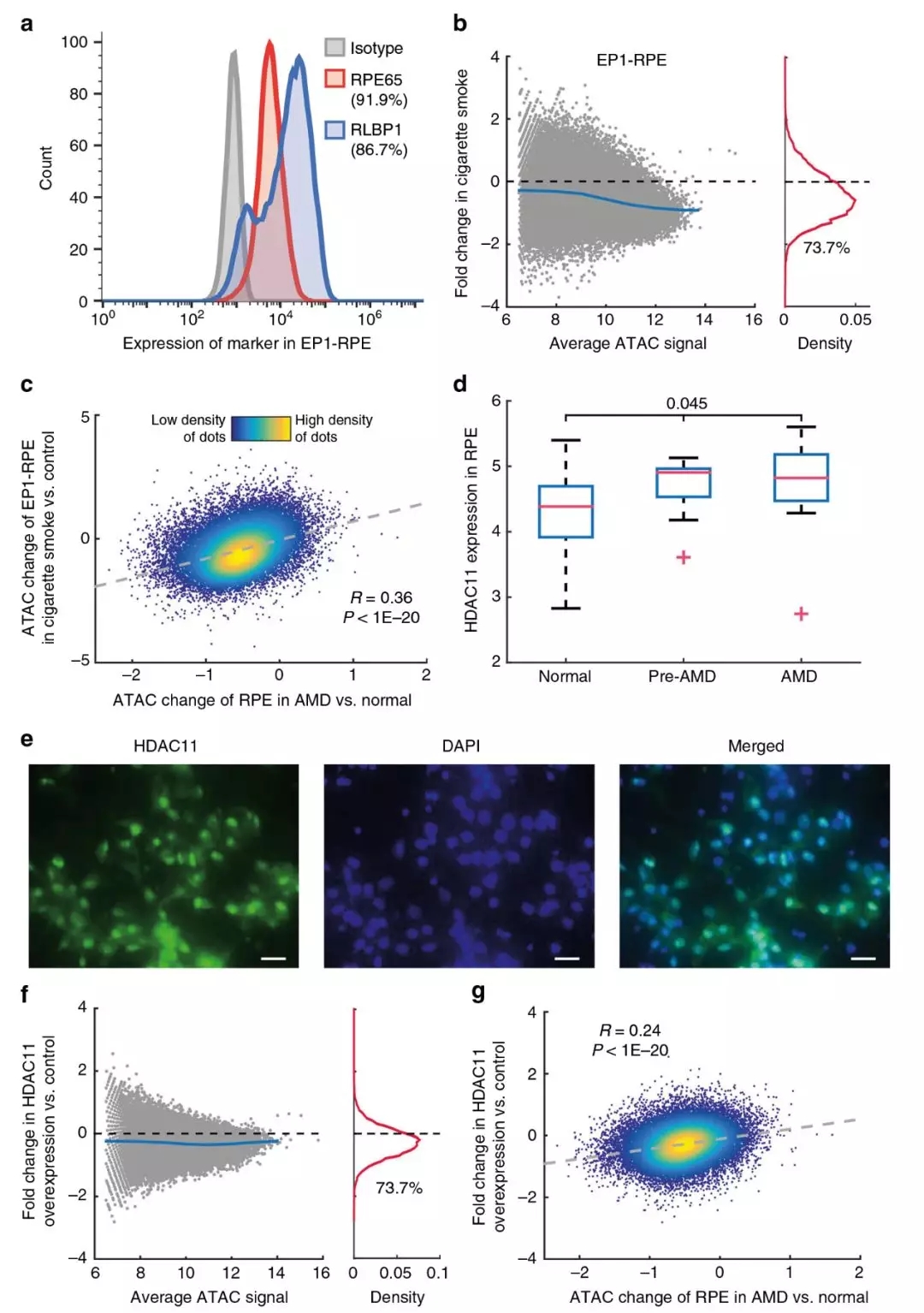
圖5 香煙煙霧處理或HDAC11高表達RPE細胞染色質可及性的變化
8、HDAC11過度表達導致染色質可及性降低
通過RNA-seq找到在AMD發展過程中可以引起染色質可及性變化的差異表達基因。在所有組蛋白脫乙酰酶(HDAC)基因中,發現AMD和對照組之間有三個基因(HDAC10、HDAC11、SIRT1)顯著差異表達。然而,HDAC11在RPE中的表達在疾病早期顯著增加(圖5d),并且主要局限于RPE細胞的細胞核(圖5e)。并觀察到HDAC11高表達細胞的染色質可及性相對于轉染空載體的細胞普遍降低(圖5f)。HDAC11過度表達引起的變化與AMD患者RPE的變化非常一致(圖5g)。這些結果說明HDAC11的過度表達可能是AMD進展中染色質可及性降低的部分原因。
老年性黃斑變性(AMD)是老年人視力下降的重要原因。表觀遺傳改變在多大程度上調節AMD的進展尚不清楚。該研究使用ATAC-Seq對AMD患者和對照組的視網膜和視網膜色素上皮細胞(RPE)的染色質可及性進行了全局性分析。染色質可及性的整體下降發生在早期AMD的RPE和晚期疾病的視網膜中,這表明RPE的功能障礙導致疾病的發生。光感受器和RPE特異性轉錄因子的足跡在差異可及區域(DARs)中富集。與DARs相關的基因在AMD中表達改變。吸煙對RPE細胞的處理再現了AMD患者染色質可及性的變化,為AMD的已知危險因素與AMD病理學之間提供了表觀遺傳學聯系。最后,HDAC11的過度表達是導致染色質可及性下降的部分原因,提示HDAC11可能是AMD潛在的新治療靶點。