2020-10-15
單細胞轉錄組測序技術即在單個細胞水平上,對轉錄組進行高通量測序分析,其讓研究人員能夠獲取之前經常會被大量細胞的RNA-seq方法所掩蓋的關鍵數據,如罕見或新的細胞類型,從而在單細胞水平上探索基因表達多樣性。
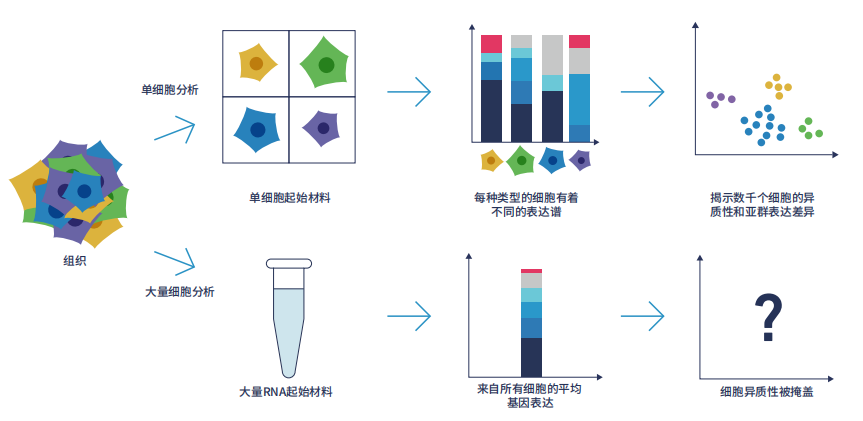
圖1.單細胞測序揭示了被傳統的大量細胞RNA-seq方法所掩蓋的細胞異質性。
10x Genomics 作為單細胞轉錄組測序技術主流平臺之一,能實現大規模的單細胞轉錄組測序,具有細胞通量高、細胞捕獲率高、項目周期短等優點,并廣泛應用于細胞異質性、免疫細胞群體檢測及構建細胞圖譜等研究。
接下來為大家介紹下10X Genomics單細胞測序的技術原理及樣本制備時所需滿足的要求。
技術原理
Gel beads及其核酸序列構成
Gel beads,即凝膠微珠。每個凝膠微珠上有40-80萬特定的核酸引物序列,該序列由以下幾部分構成:Read 1 測序引物、10X Barcode序列(16 nt,一個Gel bead對應一種10X Barcode,共有~350W種10X Barcode,用于區分細胞)、UMI(unique molecular identifier,12 nt,隨機序列,區分同一細胞的不同轉錄本)、poly dT反轉錄引物(30nt)。
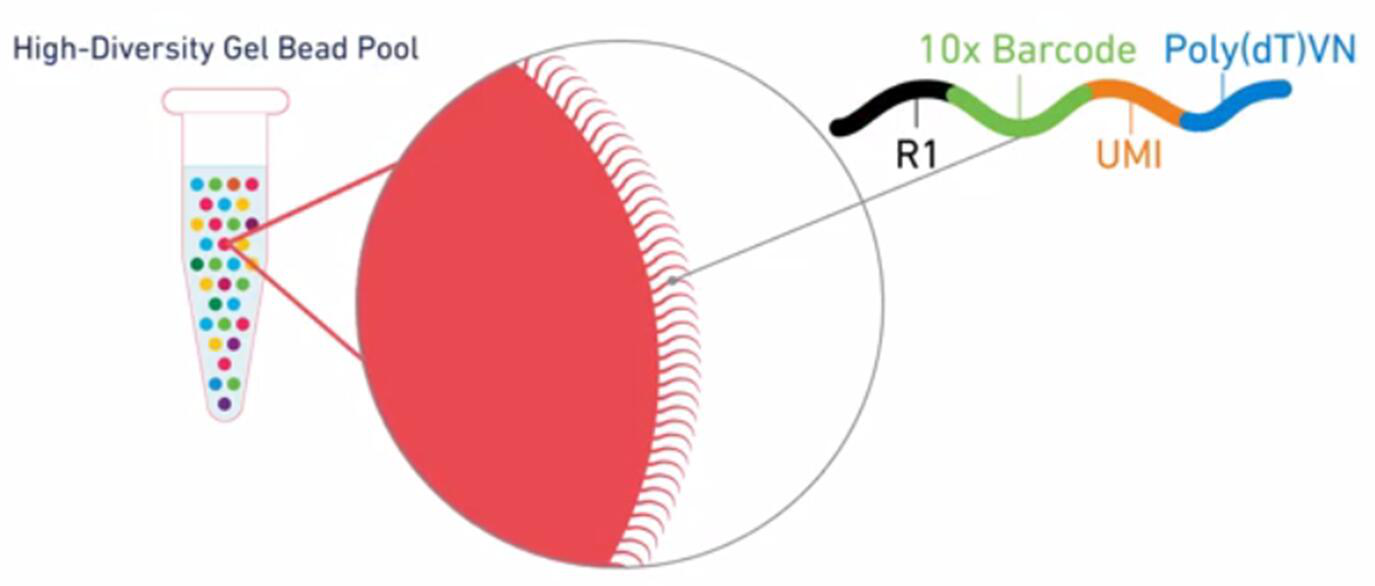
圖2.Gel beads構成
微流控技術
如圖,在10X Genomics Chromium的8通道的微流體“雙十字”交叉系統中,Gel Beads與細胞/酶的混合物在第一個十字交叉口結合,然后在第二個十字交叉口,油將Gel Beads與細胞/酶的混合物包裹起來,形成油包水結構,即GEM(Gel Beads-in-emulsion)。
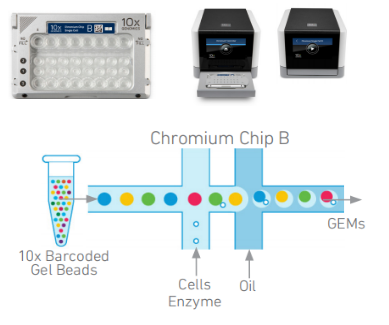
圖3.微流控技術
GEMs形成后,細胞裂解,Gel Beads自動溶解釋放大量barcode序列,這些序列與mRNA相結合,隨后mRNA逆轉錄產生cDNA;將得到的cDNA進行純化、富集,用于后續構建標準測序文庫。其中,來自同一細胞的cDNA序列均帶有對應凝膠微珠所特有的相同的Barcode標簽,并且每個cDNA分子各自還會帶有特定的UMI標簽。
綜上,微流控技術實現了單個細胞的分離;Barcoding技術則區分不同的細胞以及同一細胞中同一基因的不同轉錄本。
前期單細胞懸液樣本制備所需滿足要求
1.細胞重懸Buffer
在處理懸浮細胞系、解離組織或大量細胞時,建議對細胞進行徹底的清洗,避免影響后續的細胞回收效率。推薦使用1X PBS(calcium and magnesium free)with 0.04% BSA (400 μg/ml)清洗、重懸細胞。此外,對于敏感的細胞類型,也可選擇替代的溶液或者培養基進行細胞清洗及重懸。
Alternative Buffers :
? Dulbecco’s Phosphate-Buffered Saline (DPBS)
? Hank’s Balanced Salt Solution (HBSS)
Alternative Media :
? Eagle’s Minimum Essential Medium (EMEM) + 10% FBS
? Dulbecco’s Modified Eagle Medium (DMEM) + 10% FBS
? Iscove’s Modified Eagle Medium (IMEM) + 10% FBS
? Roswell Park Memorial Institute (RPMI) + 10% FBS
? Ham’s F12 + 10% FBS
? 1:1 DMEM/F12 +10% FBS
? M199
2.細胞懸液過濾
大的細胞團塊、雜質或碎片會增加微流體芯片的堵塞風險,并且干擾準確的細胞計數,從而影響細胞回收。為了避免這一問題,建議使用孔徑為30-40μm的細胞篩網對細胞懸液進行過濾;此外,如果懸液中存在大量紅細胞,會干擾后續細胞的準確計數,建議使用紅細胞裂解液去除紅細胞,確保制備的單細胞懸液中無明顯雜質,無細胞碎片,無細胞粘連,無紅細胞干擾。
3.細胞活性及濃度
在細胞清洗和過濾之后,需測定其細胞活性及濃度,以判斷細胞狀態并確定上樣時的準確體積。推薦使用臺盼藍染色法或者熒光染色法來檢測細胞活性;同時可采用細胞計數設備(如血球計數器或自動細胞計數儀)進行定量。
當細胞活性>80%且濃度介于700-1,200 cells/μl(體積不少于100μl)時,捕獲細胞數及基因檢出率更容易達到目標值。細胞懸液的濃度一旦超出這個最佳范圍,將會導致細胞計數不可靠,建議相應地調整細胞懸液的濃度;而高比例的死細胞可能會影響目標細胞的捕獲,并且會釋放核酸造成背景噪音,因此對于死細胞比例較高(>20%)的樣本,建議使用去死細胞試劑盒/磁珠分選/流式分選的方式降低單細胞懸液中的死細胞比例。

圖4.自動細胞計數儀檢測細胞活性
4.樣本制備后的保存
為了最大限度地減少轉錄組的變化,在對細胞進行清洗、過濾和檢測后,單細胞懸液應當保存于冰上,直至用于后續的上機和文庫制備步驟。在理想狀況下,一旦制備好樣本,應當在30分鐘內將其用于下游步驟。
5.特殊細胞類型
由于10X芯片孔徑的限制,要求細胞直徑<40 μm;植物細胞需制成原生質體。


