2020-09-15

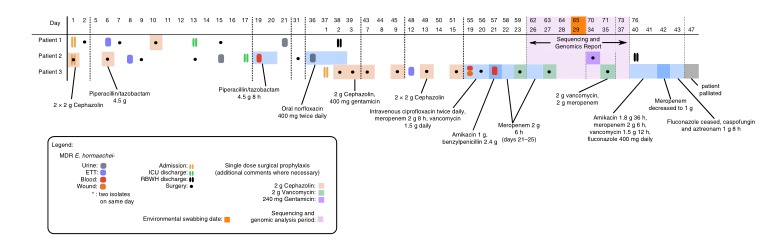
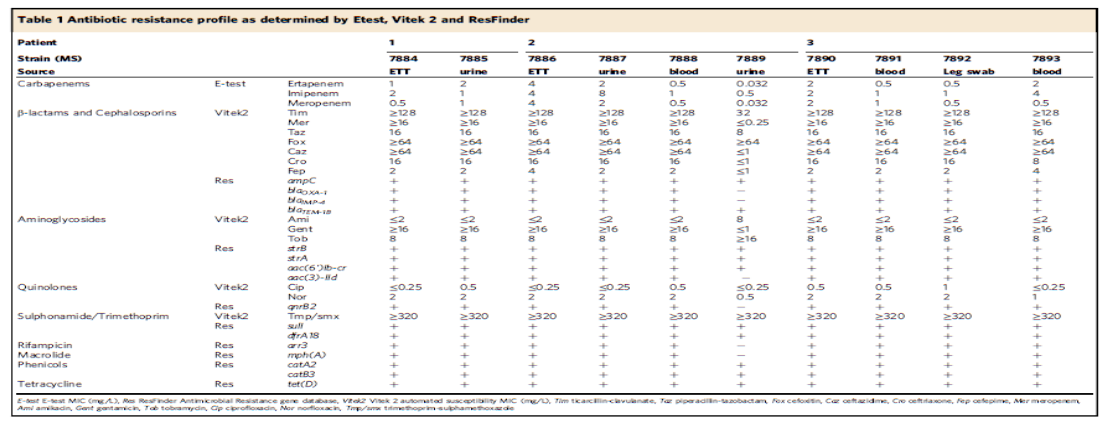
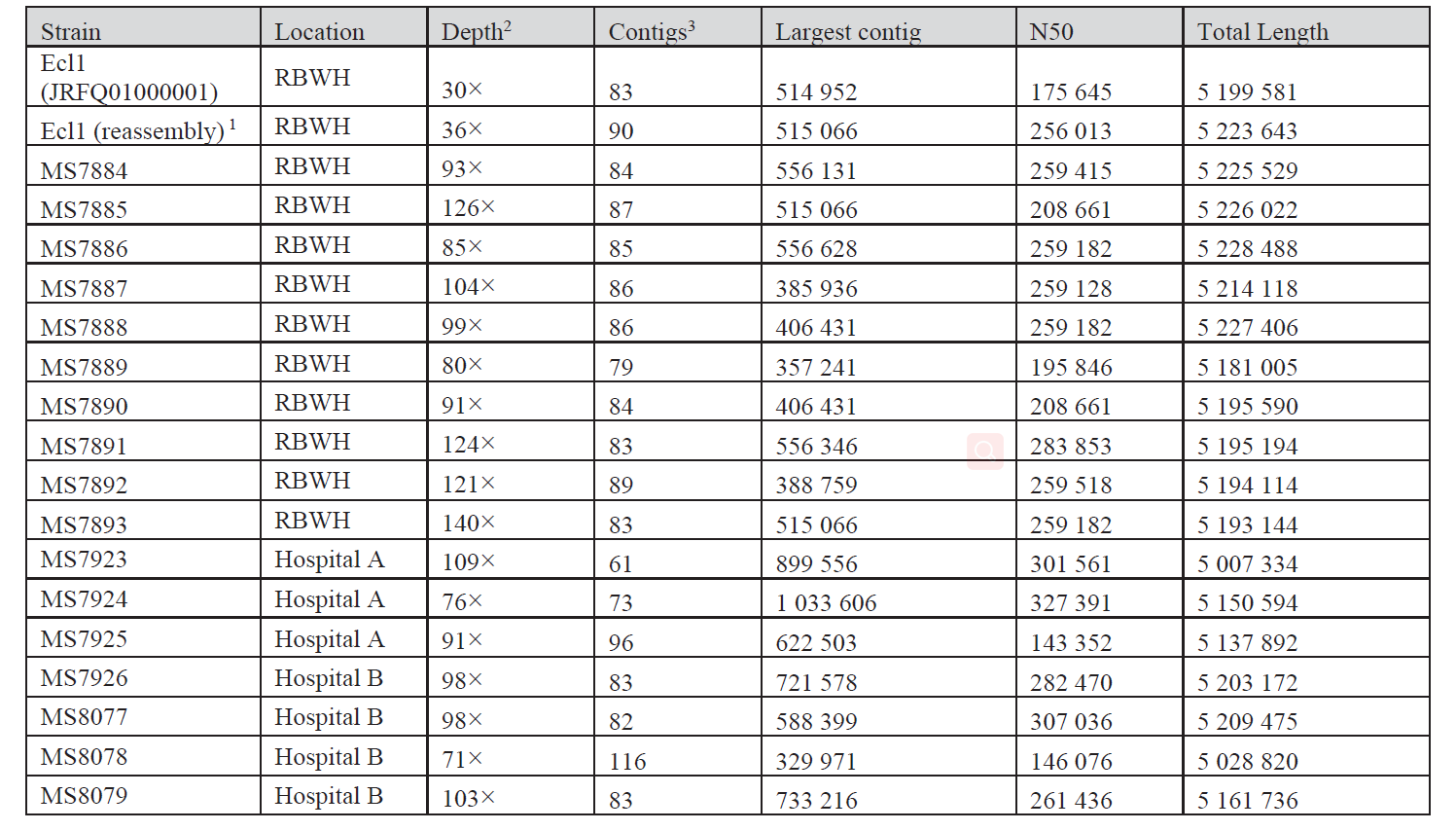
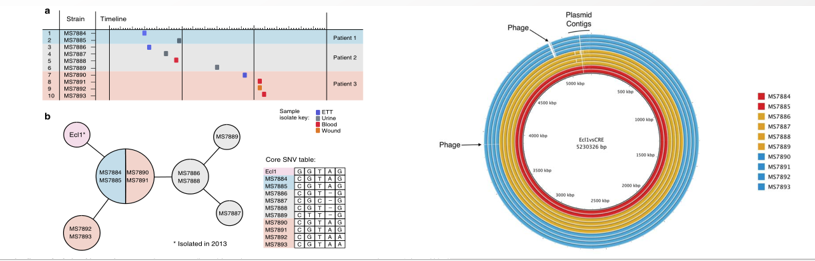
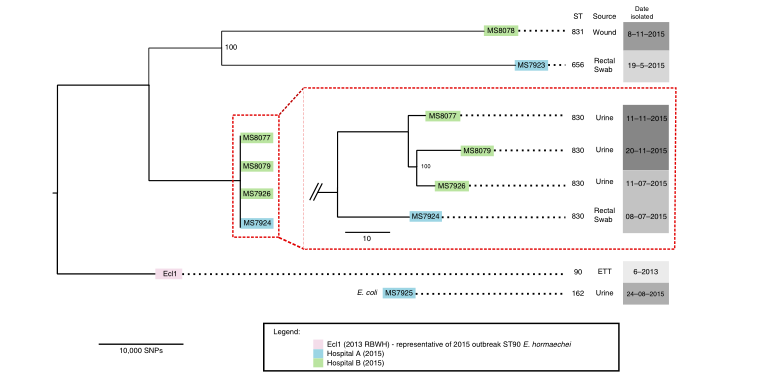
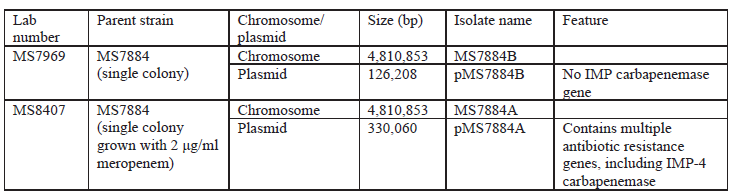
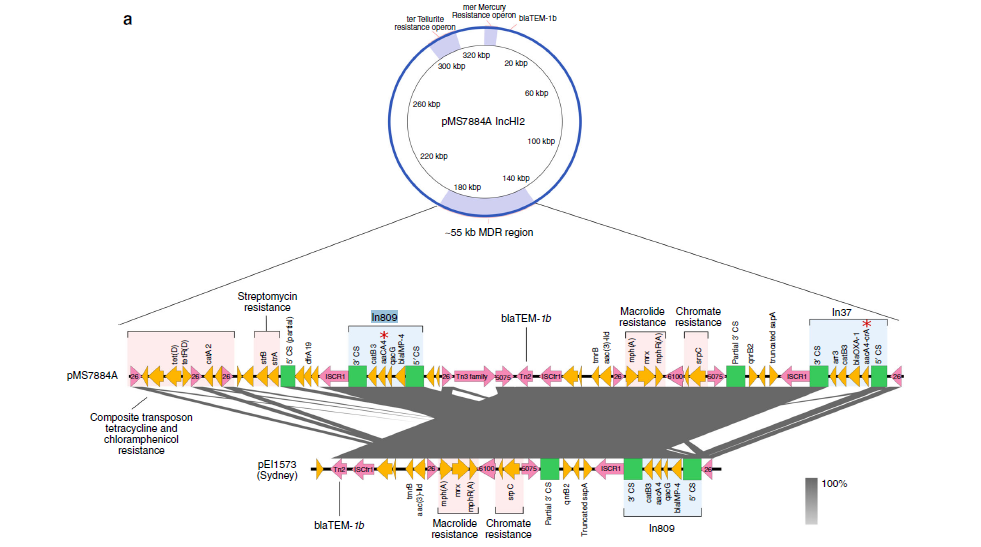
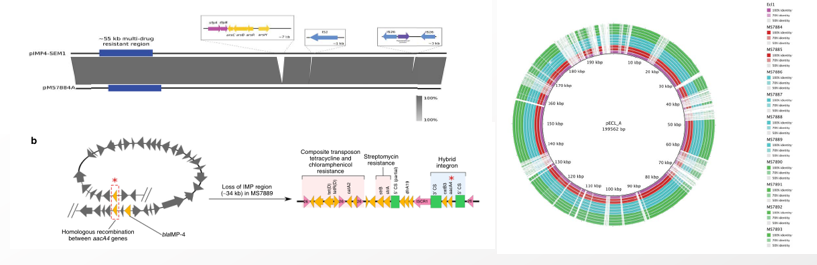
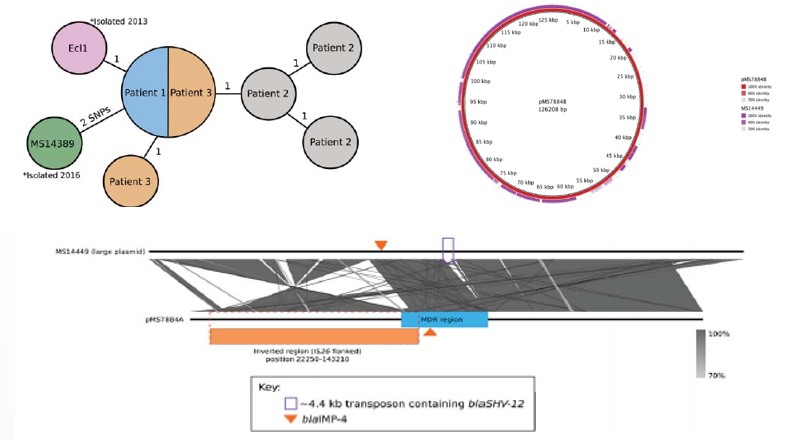
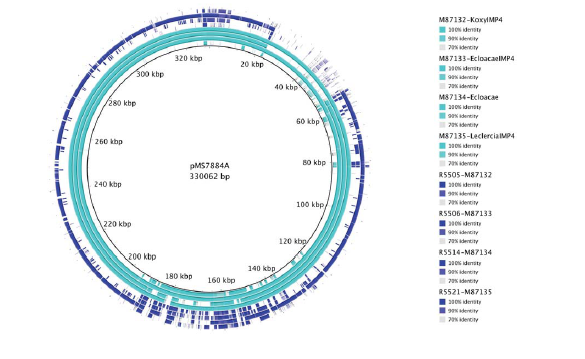
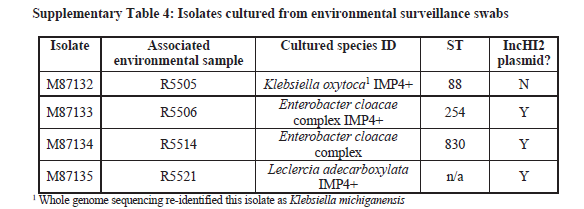
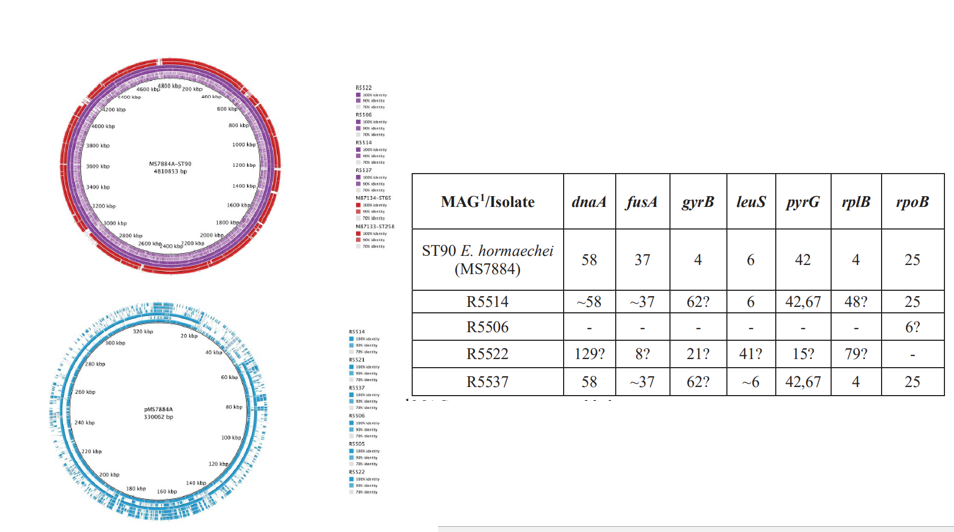
2020年1月《nature communications》期刊發表了一篇題為“Integrating multiple genomic technologies to investigate an outbreak of carbapenemase-producing Enterobacter hormaechei”的文章,該文章整合了多個平臺的測序技術(Illumina、PacBio、Nanopore)調查產碳青霉烯腸桿菌的疫情爆發情況,為疫情提供了深入分析。 研究背景 碳青霉烯抗生素已成為治療多藥耐藥(MDR)革蘭氏陰性菌引起的嚴重感染的主要藥物,該抗生素使用量的增加已導致碳青霉烯類藥物產生耐藥性,以及產碳青霉烯酶的腸桿菌科(CPE)和耐碳青霉烯酶的腸桿菌科(CRE)出現,其中包括常見的腸菌,如大腸桿菌、肺炎克雷伯菌和腸桿菌屬。 2005年以前,99.9%的腸桿菌對碳青霉烯敏感。然而,隨著CRE分離株的增加,現在世界衛生組織所有衛生區域都報道了該類微生物。據報道,CRE感染的死亡率高達48%,對用粘菌素代替碳青霉烯類的最后一線抗生素也出現了耐藥性。 腸桿菌科細菌對碳青霉烯類耐藥是通過一系列機制發生的,最令人關注的是碳青霉烯酶編碼基因的獲得,最常見的是通過移動遺傳元件(MGEs)的轉移,如質粒,偶爾攜帶多種與其他耐藥決定因素共位的多個β-內酰胺酶,使這些菌株呈MDR或廣泛耐藥性(XDR)。 在過去的十年里,全基因組測序(WGS)變得更容易獲得和負擔得起,導致其在許多領域的應用增加,包括臨床微生物學。使用WGS來表征臨床相關細菌的主要特征之一是它能夠在單個核苷酸的分辨率上提供菌株的親緣關系。WGS已被用于了解醫院環境下的傳播情況,而不僅僅是使用傳統的診斷方法來確定傳播情況。然而這些研究中很多是回顧性的,并且主要是采用單一測序技術進行進行的,鮮少采取多種測序技術來研究疫情的傳播情況。 材料與方法 1、實驗材料與方法 (1)從3位燒傷患者的不同部位采取10份樣本,周邊醫院取7份blaIMP-4陽性的菌株、進行基因組測序與傳統培養; (2)選擇ICU病房中收集到50個拭子和水的樣本以及燒傷病房等疫情爆發無關的的環境樣本進行宏基因組測序與傳統培養。 2、測序及組裝方法 (1)二代測序平臺:Illumina Hiseq、NextSeq、MiSeq; (2)三代測序平臺:Pacbio、Nanopore MinION (3)組裝方法:Spades(v3.6.0和v3.11.1)、Canu (v1.3)、SMRT Analysis suite (version 2.3.0); 3、比較基因組分析 基因核心基因組SNP進化樹構建;MLST分型;質粒分型;ANI分析;比較基因組圈圖。 實驗結果與分析 1、臨床實驗 2015年年中,RBWH ICU收治了3名燒傷患者。患者1和2在同一天入院,入院后,兩名患者均出現耐碳青霉烯感染。患者1取兩份樣本(氣管插管和尿液),患者2取四份樣本(氣管插管、尿液和血)。患者3于患者1、2出院37天后入院,患者3也因對碳青霉烯耐藥的陰溝腸桿菌感染而感染,并從氣管插管、血液和傷口部位提取了四份樣本。經過抗生素和抗真菌治療,患者在入ICU的第47天得到緩解。在確認三位患者感染了產blaIMP-4的Enterobacter hormaechei后,對所有10個分離株進行了測序和基因組學分析。 對得到的分離株進行藥敏實驗,發現除MS7889(在第36天從患者2的尿液中分離)外,其他分離株對頭孢曲松、頭孢他啶、替卡西林-克拉維酸、哌拉西林-他唑巴坦、美羅培南、慶大霉素和磺胺甲惡唑均耐藥,MS7889則對碳青霉烯類完全敏感。 2、Illumina、Pacbio、Nanopore測序 對10個分離株進行WGS測序,結果表明所有的分離株都為ST90類型、都含有IncHI2質粒,大多數都有相同的抗性基因,包括100%相同的blaIMP-4基因(MS7889除外)。與數據庫進行比對發現,分離株與2013年從被火燒傷的病人身上分離的ST90型菌株Ecl1近緣,并且表現出相同的耐藥基因圖譜。 以Ecl1為參考基因組進行SNP分析,發現RBWH分離株的差異小于5個核心SNP,這與祖先的進化關系一致。其中患者3缺失了一個原噬菌體,但是患者1的兩個分離株和患者3的兩個分離株在核心基因組水平上無法區分。Ecl1與這些分離株非常密切相關,不同的只有一個核心SNP。來自患者2的所有四個分離株均含有特定的SNP缺失,排除了患者2至患者3的傳播。 為了確定周圍醫院產IMP腸桿菌的情況,對7個產blaIMP-4的分離株進行測序,MLST和SNP分析沒有發現其與Ecl1之間有聯系(與Ecl1親緣關系最近的菌株也有50000個SNP)。雖然不是克隆株,但所有腸桿菌科分離株都具有非常相似的抗生素抗性基因譜,這可能通過MGEs(例如整合子和/或質粒)進行橫向基因轉移。WGS分析顯示,本研究中的所有18個大腸桿菌分離株,都含有一個IncHI2質粒和一個相同的BLAIMP-4基因,這強烈表明醫院腸桿菌科之間BLAIMP-4的質粒介導循環。 對具有代表性的MS7884分離物進行Pacbio測序,得到了4.8M左右的染色體和兩個質粒。質粒pMS7884A長330,060bp,攜帶多個抗性操縱子以及一個~55kb的MDR區域。MDR區域被發現含有兩個1類整合子(In809,In37)以及其他幾個抗生素耐藥基因。將這一多藥耐藥區域與公開的基因組進行比較,發現與2012年從澳大利亞悉尼的陰溝腸桿菌分離出的pEl1573非常相似。而pMS788B為不可分型質粒,大小為126,208bp,不含有抗生素抗性基因。 除MS7889外,Illumina測序的另外17個分離株中都存在相同的質粒;由于兩個幾乎相同的氨基糖苷類耐藥基因之間的同源重組,MDR質粒(包括blaIMP-4)中丟失了約34 kb區域。值得注意的是,在15%的病例中,MS7884在美羅培南缺陷培養基中,會導致BlaIMp-4基因或整個質粒的丟失。 為了更好的了解MS14449與2015年的腸桿菌分離株之間的關系構建進化樹,根據進化樹來MS14449不屬于ST90分型(后續Illumina測序發現該菌株屬于新的ST175分型)。MS14449測序后與pMS7884A進行核苷酸比對,表明MS14449可能存在一個高度相似的質粒,但是pMS7884A與MS14449相比可能存在部分MDR基因的缺失。 3、宏基因組測序 使用傳統的培養方法對醫院環境進行檢測,并未發現ST90型環境來源的腸桿菌。2018年5月,從ICU病房中收集到50個拭子和水的樣本以及燒傷病房等疫情爆發無關的的環境樣本進行測序和傳統培養。傳統培養檢測到Klebsiella oxytoca, E. cloacae complex 和Leclercia adecarboxylata,Illumina測序確定這些分離株與疫情無關,但是這4株分離株中有3株上含有blaIMP-4基因,進一步比對發現其對應的IncHI2質粒與pMS7884A高度一致。 宏基因組組裝結果與參考基因組Enterobacter hormaechei在染色體和質粒水平上有很高的相似性,ANI平均在93%-97%之間。MLST分析也能檢測到一個幾乎相同的等位基因ST90,抗性基因篩查也發現了blaIMP-4基因,和IncHI2型質粒的存在。 結論與討論 1、通過Illumina測序,發現所有的產碳青霉烯的腸桿菌分離株序列都為ST90,且幾乎相同;與公開可獲得的數據進行比較,所有爆發的分離株都可以與該病在2013年一株分離株相聯系起來,表明該醫院存在環境來源; 2、使用Pacbio測序,發現了不同醫院產IMP-4菌株中的IncHI2質粒上blaIMP-4基因的完整背景; 3、對醫院管道中的樣本進行宏基因組測序發現了ST90型腸桿菌和IncHI2質粒; 4、Nanopore測序結合Illumina測序迅速解決了后續分離物與最初爆發的真實關系。 雖然在WGS的成本和可用性方面有了顯著改善,但將這些進展納入常規臨床微生物學仍是一個挑戰。這幾項研究表明,WGS能夠在菌株之間提供最佳區分,從而有助于告知對暴發或醫院內感染的反應。在此,本文證明,綜合WGS方法可以幫助快速確定危重護理環境中的疫情,特別是傳播途徑。 文章索引:Roberts L W , Harris P N A , Forde B M , et al. Integrating multiple genomic technologies to investigate an outbreak of carbapenemase-producing Enterobacter hormaechei[J]. Nature Communications, 2020, 11(1). 點擊閱讀全文:https://www.nature.com/articles/s41467-019-14139-5#citeas