
2020-07-12
什么是KRAS基因
KRAS基因的全名叫Kirsten ratsarcoma viral oncogene homolog,翻成中文是“Kirsten大鼠肉瘤病毒癌基因同源物”。KARS基因編碼的蛋白是一種小GTP酶(smallGTPase),它屬于RAS超蛋白家族,ras基因家族與人類腫瘤相關的基因有三種—H-ras、K-ras和N-ras,分別定位在11、12和1號染色體上。KRAS蛋白質有188個氨基酸,它的分子量是21.6KD。在人的基因組中,有2個KRAS基因。一個是KRAS1,位于第6號染色體的短臂上;另一個是KRAS2,位于第12號染色體的短臂上。其中,KRAS1是“假基因”,不能被轉錄成RNA,所以它是沒有功能的。而KRAS2才是“真基因”,能夠轉錄、并且翻譯成蛋白,具有生物學活性。(1)
KRAS基因的信號轉導
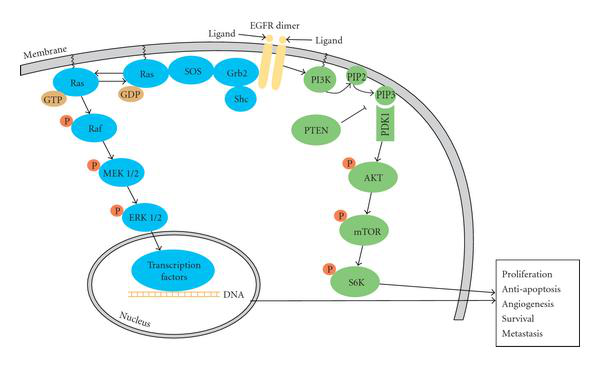
KRAS是一線傳感器之一,可啟動一系列信號分子的激活,使轉導信號從細胞表面傳遞到細胞核,并影響一系列基本細胞過程,例如細胞分化、生長、趨化性和細胞凋亡。除了上述GTP/GDP結合之外,KRAS信號的激活現在被稱為多步過程,需要適當的KRAS后翻譯,質膜定位以及與效應蛋白的相互作用。這些機制的見解為探索KRAS信號靶向療法鋪平了道路。
新合成的KRAS是胞質和非活性蛋白。一系列的翻譯后修飾發生在C末端CAAX(C,半胱氨酸;A,脂族氨基酸;X,末端氨基酸)四肽基序列上,從而使KRAS膜結合。下一步是通過RAS轉換酶1(RCE1)進行蛋白水解去除,這發生在內質網的胞質表面。之后,異戊二烯半胱氨酸羧基甲基轉移酶(ICMT)催化甲基轉移至C端氨基酸,以消除負電荷并防止質膜排斥。另外,剪接變體KRAS-4A通過棕櫚酰轉移酶進行另外的棕櫚酰化,導致KRAS-4A適當地靶向與膜結合。然而,主要的剪接變體KRAS-4B沒有可檢測的棕櫚酰化,其可能通過微管依賴性機制到達質膜。KRAS蛋白的信號轉導并不僅僅發生在質膜上,KRAS對下游信號通路的激活也可以由亞細胞區室(例如內質網和高爾基體)發出的信號觸發。
響應細胞外刺激,從無活性的RAS-GDP轉化為有活性的RAS-GTP進一步促進了各種信號轉導的激活,包括促分裂原活化蛋白激酶(MAPK)通路,磷酸肌醇3激酶(PI3K)通路和Ral–GEFs通路,其中MAPK通路的特征最為明顯。眾所周知,RAS-GTP直接與RAF蛋白結合,從細胞質到細胞膜募集RAF激酶家族,它們在其中二聚并變得活躍。活化的RAF隨后對其下游底物即MEK和ERK進行一系列的磷酸化反應,并傳播生長信號。(2)
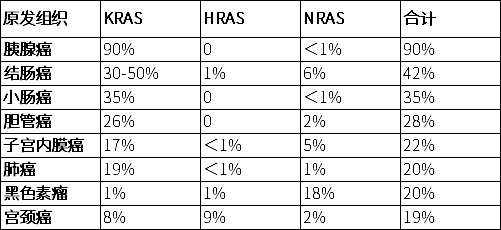
腫瘤中的KRAS基因突變
RAS家族(KRAS、NRAS、HRAS)是人類癌癥中最常見的致癌原因之一,但RAS基因突變的頻率和分布是并不統一,其中KRAS最易突變,約占RAS突變的86%。在不同的癌種中的KRAS突變頻率也有很大的差異,如在胰腺癌中突變頻率達到90%,結腸癌30%到40%。肺癌為15%到20%(主要是非小細胞肺癌NSCLC),同時在其他的癌種中也有分布(3)。
具體見下圖:
在KRAS基因中最常見的突變主要發生在12、13或61號密碼子上。KRAS突變也發生在63、117、119和146號密碼子中,但頻率較低。甘氨酸 12(G12)的突變通過干擾GAP結合和GAP刺激的GTP 引起RAS激活。水解。殘基13處的突變與精氨酸發生空間碰撞,并降低GAP結合和水解。相反,谷氨酰胺 61幫助穩定水解反應的過渡態而在催化中具有直接作用。由于GTP酶活性降低的結果,KRAS 的核苷酸狀態變得更加依賴于相關核苷酸的親和力和濃度。這使GTP具有優于GDP 的優勢,并增加了與GTP綁定的活動RAS的比例,從而導致激活狀態的持續。此外,據報道殘基12、13和61處的突變也降低了對RAF的RAS結合域(RBD)的親和力,但程度不同。(4)
KRAS,不可成藥靶點?
目前KRAS基因上的致癌突變十分清楚,那么,為什么到現在為止,仍未上市一個直接針對KRAS基因的靶向藥物?原因在于KRAS蛋白是一種無特征、近乎球形的結構,無明顯結合位點,很難合成一種能靶向結合并抑制其活性的化合物。長期以來無法攻克,KRAS已成為腫瘤藥研發領域"不可成藥"靶標的代名詞。
困難點在于:
01、 KRAS的作用泛圍很廣,KRAS的正常活性也是許多正常細胞功能所需要的活性,如選取直接抑制KRAS的藥物,則該藥物毒性可能會很大,副作用也可能會很強。且KRAS與NRAS、HRAS有很高的同源性,能抑制KRAS活性的藥物,就很可能會抑制NRAS、HRAS的活性。那么,這個藥物的毒性就可能很大。
02、目前已知的KRAS的活性功能域,主要是KRAS與GDP、或GTP結合的口袋狀的功能域。與蛋白激酶與ATP的親和力較弱不同, KRAS與GTP、或GDP的結合非常強,親合系數達到PicoMolar(皮摩爾濃度,10^-12)級。而正常細胞里面的GDP與GTP的濃度,達到了MicroMolar(微摩爾濃度,10^-6)級。所以,細胞內正常的GDP與GTP的濃度,比與KRAS結合所需的濃度,高了10的6次方倍。而RAS缺乏足夠大的能夠結合小分子的口袋;故要做出一種小分子化合物,其與KRAS的結合能力,要能與GDP、或者GTP相匹敵,非常難。
03、設計一種只針對性抑制突變KRAS蛋白的活性藥物,而盡量少影響正常KRAS蛋白的活性,需要此種化合物對突變的KRAS有很好的選擇性。這是藥物設計的又一個難題。
04、然而,間接靶向KRAS的策略也是困難重重,包括阻斷KRAS細胞膜定位和靶向KRAS下游的信號分子,如RAF、MEK、ERK和PI3K等家族成員。具體而言,間接途徑的困難包括:
(1)RAS是正常細胞生長和存活相關的必需途徑,靶向必需途徑首先面臨嚴重的毒副作用,導致療效指數非常狹窄甚至沒有;
(2)補償逃逸機制;
(3)由于嚴格調節導致的信號反饋和冗余。
綜上,就是到目前為何沒有直接針對KRAS的靶向藥物上市的主要原因。
而在2019年,針對KRAS這一靶點的抑制劑AMG510終于攻破了這一堡壘,讓“不可成藥”的魔咒將成為歷史。這款有望攻克KRAS的抗癌新星已經來到中國,即將正式開展臨床試驗。
2019年3月9日,CDE(國家藥監局藥品審評中心)官網公布,安進公司研發的KRAS G12C抑制劑AMG 510準備在中國申請臨床試驗。在2020年,FDA授予了安進公司的靶向KRAS-G12C突變非小細胞肺癌患者的抑制劑AMG510快速通道,臨床試驗已在眼前。


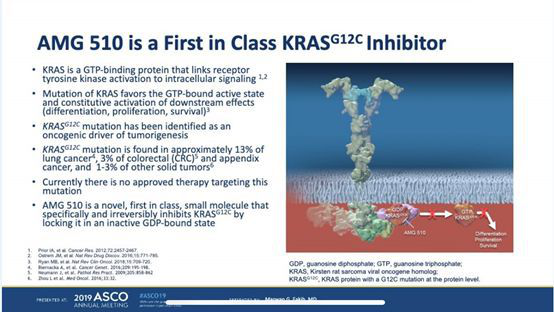
實際上關于AGM510作為KRAS(G12C)抑制劑首例藥物對于癌癥突出的治療效果,早在2019年6月初的美國臨床腫瘤學會(ASCO)上,安進公司就已經公布了該藥的Ⅰ期臨床結果,Ⅰ期臨床研究(NCT03600883),29例KRAS(G12C)突變實體瘤可供評估,其中10例為非小細胞型肺癌,19例腸癌等實體瘤。10例非小細胞型肺癌中有5例癌腫縮小,4例無明顯進展,僅有1例患者出現癌腫持續惡化。癌腫縮小的患者至學會發言時止仍在繼續服藥中(7.3-27.4周)。在其余實體瘤中反應一般,所有患者未表現有癌腫減小,僅有74%的患者表現為未進一步惡化。
另一方面AMG 510耐受性表現較好,主要不良反應為食欲下降、腹瀉、乏力、頭痛、咳嗽、潮熱和惡心,沒有發現劑量限制毒性和與藥物有關的4級以上不良反應。
KRAS基因與靶向治療
01、肺癌:由于KRAS位于EGFR受體的下游,因此KRAS突變會使EGFR酪氨酸激酶抑制劑(TKI)的治療效果降低,前瞻研究表明KRAS突變可以作為EGFR-TKIs治療反應的不良預測分子標志物。
02、結直腸癌:如果存在RAS家族突變,患者會對西妥昔單抗或者帕尼單抗整體療效產生負面影響,所以在使用藥物前需進行KRAS、NRAS、BRAF的檢測,從而實現精準用藥。
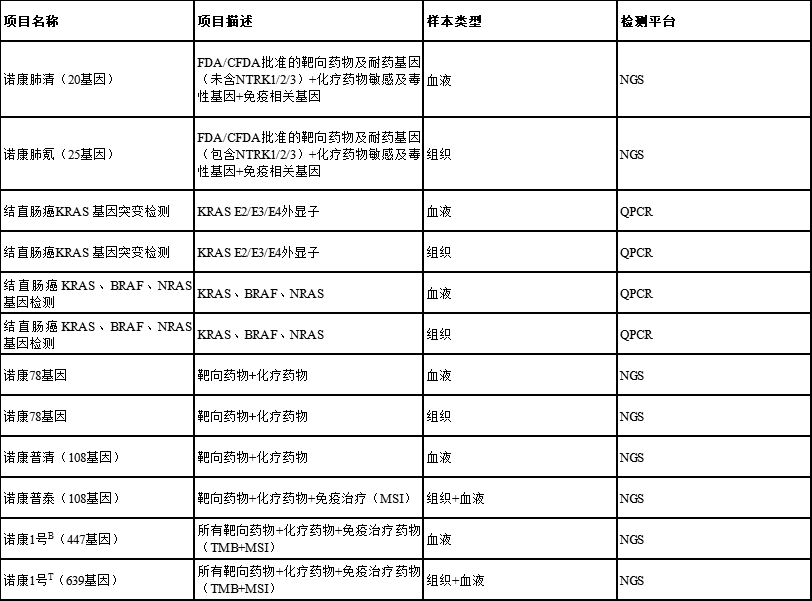
派森諾醫學腫瘤檢測產品指導相關的靶向用藥
目前,派森諾醫學基于NGS平臺(Illumina)和自主研發的高效率雜交捕獲技術開發出一系列臨床精準用藥基因檢測產品,從而進行KRAS用藥檢測,具體如下:
(1)wikopedia KRAS ;https://en.wikipedia.org/wiki/KRAS
(2)Pingyu、Yijun Wang、Xin Li,Targeting the untargetable KRAS in cancer therapy; Acta Pharmaceutica Sinica B olume 9, Issue 5, September 2019, Pages 871-879.
(3)H. Singh, D.L. Longo, B.A. Chabner,Improving prospects for targeting RAS;J Clin Oncol, 33 (2015), pp. 3650-3659
(4)J.M. Ostrem, K.M. Shokat;Direct small-molecule inhibitors of KRAS: from structural insights to mechanism-based design,Nat Rev Drug Discov, 15 (2016), pp. 771-785