
2020-03-31

這篇文章的研究背景、所使用的研究技術以及研究結論請看:干貨 | Nature文章是怎么利用高通量測序做表觀遺傳的(一)。(點擊查看)
重要提示
以下內容篇幅較長,詳細介紹了整個研究過程與結論,推薦對ChIP-Seq以及DNA甲基化等表觀遺傳研究感興趣的老師繼續閱讀。
PS:比大家直接閱讀原文省力多了呢,英語大神除外(?_?)。如有與原文表述不符的地方歡迎大家留言指正!
1、為了描述組蛋白PTMs(翻譯后修飾)在調節DNA甲基轉移酶(DNMT)靶向和CpG甲基化中的作用,使用ChIP-seq在C3H10T1/2小鼠間充質干細胞(mMSCs)中分析了組蛋白PTMs (H3K36me3、H3K36me2、H3K27me3、H3K9me3、H3K4me1)和DNMT3A/B的全基因組分布模式。使用全基因組亞硫酸氫鹽測序(WGBS)在分析CpG甲基化水平(測序深度45x)。結果發現H3K36me2和H3K36me3的富集區域非常接近,它們共同標定了Mb大小的區域,這些區域基本上不屬于H3K9me3和H3K27me3所標定的區域。
H3K36me2水平與CpG甲基化呈正相關,與H3K27me3和H3K9me3一起,這些組蛋白PTMs分別將基因組分成CpG甲基化水平高(75%)、中(50%)和低(30%)的區域。此外,DNMT3A/B ChIP-seq reads主要出現在H3K36me2/3結構域中,這表明這些結構域中的CpG甲基化水平較高,至少部分原因是因為DNMT3A/B。與H3K36/CpGmehigh結構域相關的其他染色質特征,包括H3K27ac、H3K4me1水平的升高和基因表達的增加與先前將H3K36me2/3與活性基因轉錄聯系起來的報道一致。此外,H3K36/CpGmehig結構域與小鼠成肌細胞的Hi-C研究中發現的區隔和拓撲相關結構域(TADs)相對應,這表明這些修飾共同定義了轉錄活性常染色質,它在空間上與構成性和兼性異染色質分離。觀察放入結果與最近有關H3K36me3介導靶向DNMT3B活性的報道一致。然而,由于這種相互作用僅限于基因體,假設,一個額外的染色質反式調節通路可能會平行作用以促進常染色質區域CpG甲基化。在進一步的檢測中,發現H3K36me3在基因體中表現出特征性的富集,而H3K36me2則表現出更為彌散的分布,包括基因區和基因間區。在活躍轉錄的基因中,H3K36me2通過第一個內含子覆蓋了TSS下游的區域,然后在第一個剪接連接后切換到H3K36me3。值得注意的是,當DNMT3B在含有H3K36me3的基因體中富集時, DNMT3A的定位與H3K36me2的相仿,并跨越了較寬的基因間區域,而H3K36me3的水平并不明顯。通過比較全基因組H3K36me2和H3K36me3的存在位置,可以校正de novo DNMTs的靶向譜。與H3K36me3相比,DNMT3A在H3K36me2高水平的基因組區域選擇性富集DNMT3B。
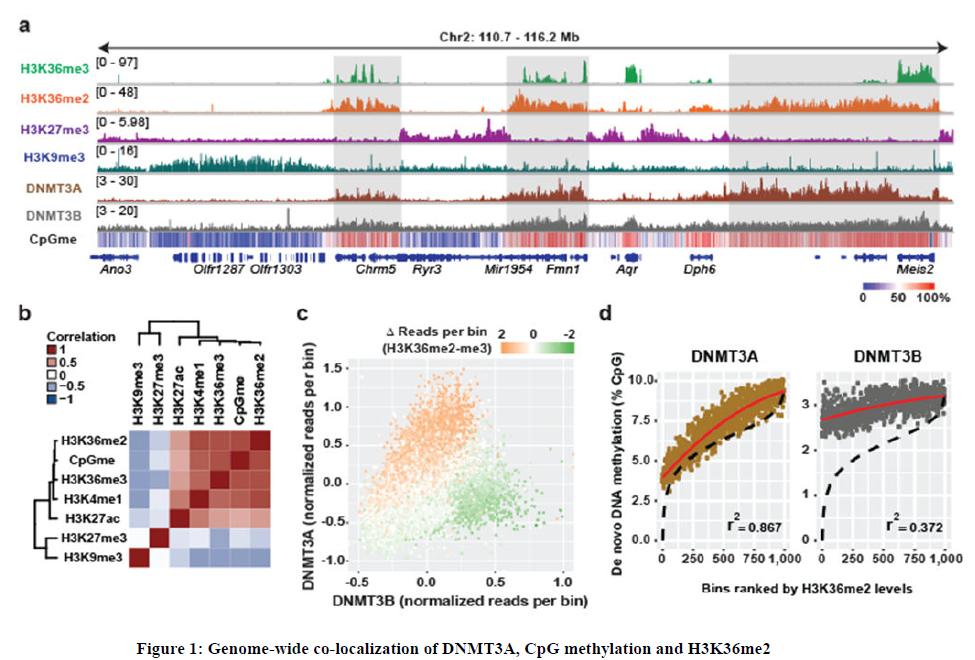
2、為了在另一個背景下證實上述結果,研究確定了H3K36me2是否在建立小鼠胚胎干細胞(mESCs)基因組甲基化過程中發揮了類似的重要作用。在親本和DNMT3A缺陷(sgDnmt3a)的mESCs中穩定表達了主要DNMT3A亞型DNMT3A2 (HA)標記的血凝素。當表達接近生理水平時,當HA標記的DNMT3A的ChIP-seq顯示其在親代細胞和sgDnmt3a細胞間的全基因組定位模式相似。與H3K36me2/3的ChIP-seq譜相比,H3K36me2-DNMT3A與H3K36me3-DNMT3B之間的選擇性共富集是明顯的,但總體上,DNMT3A與DNMT3B在mESCs中的分布模式呈正相關。重要的是,DNMT3A的de novo甲基化活性是通過重新引入DNMT3A2到Dnmt1和Dnmt3a /b三者共敲除mESCs后的CpG甲基化水平來測量的,這些mESCs幾乎不存在CpG甲基化,追蹤H3K36me2的水平。這與Baubec等人觀察到的DNMT3B的de novo活性與H3K36me3相關形成了對比,這表明DNMT3A的基因間靶向和DNMT3B的基因體靶向共同促進了在常染色質中CpG甲基化的建立。
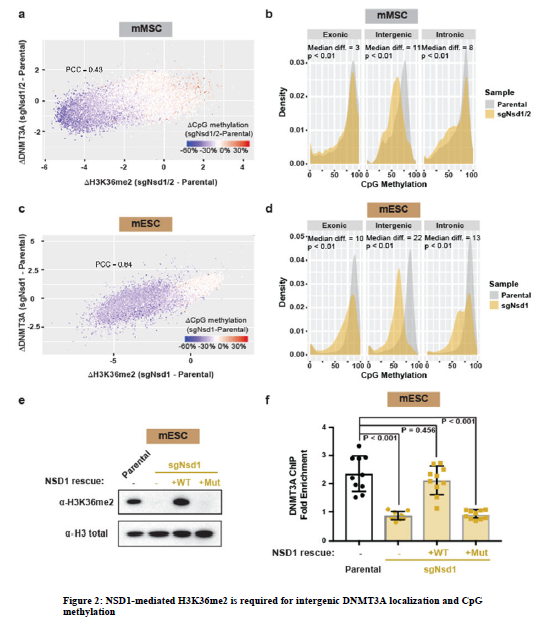
3、NSD家族酶已被證明可以在基因間區催化H3K36me2。在mESCs中,Nsd1是NSD的主要表達酶,而Nsd1和Nsd2均在mMSCs中表達。因此,研究使用CRISPR/Cas9對mMSCs中的Nsd1和Nsd2 (sgNsd1/2)或mESCs中單獨對Nsd1 (sgNsd1)進行了基因基因切除。以Setd2被單獨打斷作為對照(sgSetd2)。sgNsd1/2和sgSetd2 mMSCs中H3K36me2和H3K36me3分別顯著減少和特異性減少,表明這兩種酶在染色質水平上的作用明顯。利用添加了果蠅染色質的ChIP-seq作為外源性參考對照,被用來定量分析親代細胞和H3K36me2 /3缺失細胞之間的全基因組變化。在sgNsd1/2 mMSCs和sgNsd1 mESCs中,H3K36me2全面降低,主要在基因間區。相比之下,H3K36me3水平未受干擾,基因H3K36me2的減少相對溫和,這可能是由于NSD3或ASH1L等其他H3K36甲基轉移酶的活性。
4、接下來,分析了HA標記的DNMT3A1(用于mMSCs)和DNMT3A2(用于mESCs)的全基因組結合模式,以及H3K36me2缺失細胞中的DNA甲基化。通過刪除mESCs和mMSCs中的NSD家族酶消除了DNMT3A在基因間區域的招募。全基因組分析顯示,靶向H3K36me2缺失區域的DNMT3A缺失與CpG甲基化減少相一致(圖2a,c)。根據H3K36me2和CpG甲基化下降之間的共定位和H3K36me2基因間不平衡富集的預測,sgNsd1/2 mMSCs和sgNsd1 mESCs中的CpG低甲基化主要影響基因間區域(圖2b,d)。重新引入野生型NSD1,但不是催化突變型(C2023A),能夠恢復全面的和基因間的H3K36me2水平。重要的是,DNMT3A的基因間定位只能通過外接野生型NSD1來恢復,這表明NSD1催化的H3K36me2在將DNMT3A招募到非編碼的常染色體區域中有特定的需求。因此,得出結論,NSD1在引導DNMT3A進入基因間區和維持CpG甲基化方面起著重要和特殊的作用。
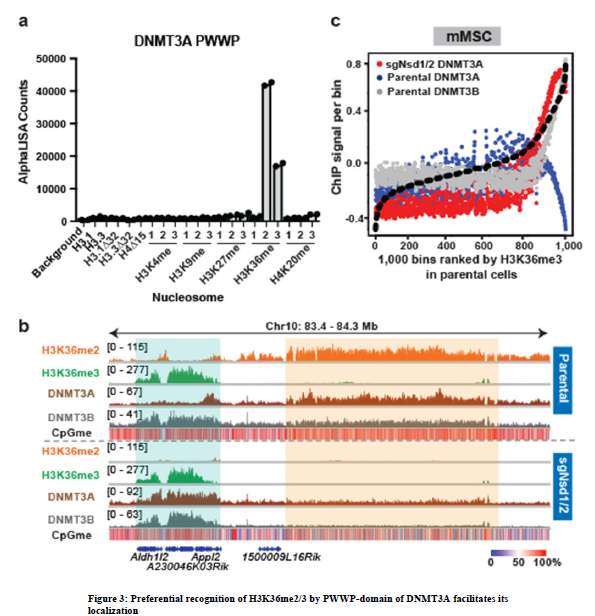
5、接下來,試圖闡明H3K36me2介導的DNMT3A募集特異性背后的機制。含有PWWP‘reader’結構域的DNMT3A和DNMT3B都含有可以在體外與H3K36甲基化相互作用。為了測試DNMT3APWWP對不同價的H3K36甲基化的特異性,檢測了純化的DNMT3APWWP結構域和一組半合成核小體之間的相互作用。DNMT3APWWP與H3K36me2修飾的核小體的親和力最高,其次是H3K36me3,但不與H3K4、H3K9、H3K27或H4K20的任何價態結合。定量等溫滴定量熱法(ITC)測定H3.1或H3.3 K36修飾肽段和DNMT3APWWP進一步支持其優先識別H3K36me2/3。這些結果表明DNMT3APWWP可以識別這兩種甲基化狀態,但對H3K36me2的親和力更強。
6、研究推測,結合H3K36me2的相對豐度,這種結合偏好有助于DNMT3A在基因間區域的富集。因此,驗證了DNMT3A在H3K36me2耗盡時與H3K36me3共定位的假設。事實上,注意到在sgNsd1/2 mMSCs中DNMT3A顯著地重新分配到基因體中。這不能通過其與剩余基因H3K36me2的相互作用來解釋,因為DNMT3A現在顯示出與DNMT3B結合的輪廓,其中信號被富集到基因體的3 '端。此外,在親代mMSCs中,DNMT3A在高H3K36me3區域被耗盡,而在sgNsd1/2細胞中,DNMT3A在相同區域被富集。sgNsd1/2細胞(TKO)中SETD2催化活性的中斷破壞了DNMT3A在基因體中的定位,反映了DNMT3A基因組重新靶向中對H3K36me3的需求。在PWWP區域引入一個點突變(D333A),該突變削弱了其與H3K36me2/3的結合,終止了DNMT3A在sgNsd1/2細胞中重新定位到H3K36me3富集區。綜上所述,這些結果表明PWWP域優先識別H3K36me2/3引導DNMT3A跨細胞染色質定位。
7、想知道DNMT3B是否也會發生類似的再分配機制。從其定位模式可以看出,DNMT3B的PWWP結構域在體外優先與H3K36me3重組核小體結合。在H3K36me3缺失的sgSetd2 mMSCs中DNMT3B的基因體定位缺失伴隨著相對溫和的向H3K36me2富集的基因間區重定向的增加。總的來說,這些數據支持H3K36me2/3比值是確定DNMT3A和DNMT3B靶向模式的關鍵決定因素,在一定程度上也支持H3K36me2/3比值是確定DNMT3A和DNMT3B靶向模式的關鍵決定因素。
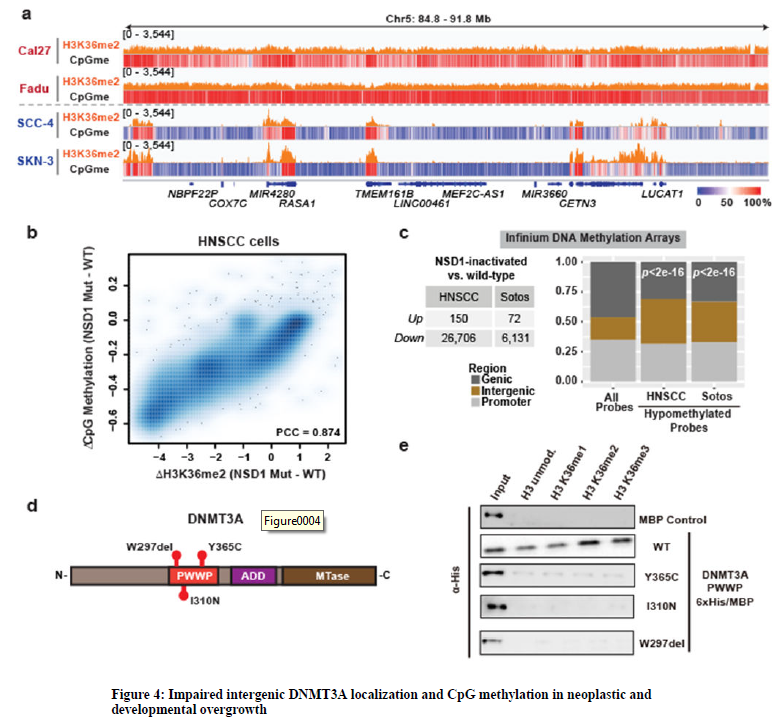
8、之前報道過,由于NSD1的基因或生化失活導致H3K36me2缺失的頭頸部鱗狀細胞癌(HNSCCs)有一個DNA低甲基化信號。同樣,在Sotos患者的胚系NSD1單倍計量不足的血液樣本中,DNA甲基化也顯著降低。為了探索研究發現的疾病相關性,分析了攜帶野生型(Cal27和Fadu)或突變型(SCC-4和SKN-3)的患者來源的HNSCC細胞系中的H3K36me2和CpG甲基化。盡管有異質的遺傳背景,與NSD1野生型細胞系相比,NSD1突變細胞系中的DNA低甲基化與H3K36me2的全基因組減少密切相關,且主要發生在基因間區域。進一步分析了公開的HNSCC或Sotos患者樣本的DNA甲基化陣列。與NSD1野生型HNSCC腫瘤相比,NSD1滅活的低甲基化探針在基因間區顯著富集。與對照組相比,索托斯綜合征患者的基因間區也表現出低甲基化探針的富集。
9、DNMT3A的錯義突變導致 TBRS,這是一種發育障礙,與Sotos有許多共同的臨床特征,包括骨骼過度生長、面部畸形和智力殘疾。在DNMT3A PWWP區域(W297del, I310N, Y365C)對TBRS的點突變進行了特征描述。攜帶這些突變的重組表達的DNMT3A PWWP結構域在體外表現出核小體結合減少,表明它們可能損害DNMT3A的染色質招募。事實上,W297del和I310N突變降低了DNMT3A與大量染色質的關聯,最近報道的23個突變也伴隨著蛋白水平的降低。進一步檢測與染色質結合的野生型、W297del、I310N或Y365C突變DNMT3A,發現突變DNMT3A復合物中核小體上的H3K36me2水平顯著降低。因此,ChIP-seq分析表明,I310N突變取消了DNMT3A對H3K36me2全基因組的靶向性。因此,DNMT3A募集障礙和H3K36me2富集的基因間區CpG甲基化減少是與TRBS和Sotos綜合征相關的共同特征。
10、本研究發現為理解DNA甲基化在常染色體基因組中是如何建立和維持的提供了深刻見解。優先靶向DNMT3A和DNMT3B,在它們的PWWP染色質閱讀框引導下,分別將CpG甲基化到H3K36me2富集的基因間區和H3K36me3富集的基因體。同時,H3K4me3在活性啟動子上的存在破壞了DNMT3A/B的ADD結構域與組蛋白H3之間的相互作用,從而保護這些區域不受異位甲基化的影響。通過招募幾個CXXC域蛋白,優先識別CPG密集的啟動子,包括參與活性DNA去甲基化的TET家族酶和H3K36去甲基化酶KDM2B,可以進一步確保啟動子上DNA甲基化的缺失。因此,認為CpG甲基化是通過DNMT3A/B的聯合作用在廣泛的常染色體區域建立的,而轉錄起始的局部位點是保留的。然而,該發現并不排除DNMT1活性也受H3K36甲基化調控的可能性。此外,與H3K36me2/3結合的DNMT3A/B的結構表征將是確定其PWWP域選擇性識別的基礎。
11、該研究表明,功能失調的NSD1-DNMT3A跨調節通路導致的基因間DNA低甲基化,代表了兩個表型重疊的人類過度生長綜合征之間的一種機制聯系。這一途徑也可能促進組織腫瘤過度生長。Nsd1或Dnmt3a的缺失在鱗狀細胞癌小鼠模型中促進腫瘤的發展。
DNMT3A的體細胞突變在急性髓系白血病中很常見,惡性腫瘤中反復發生的將NSD1與NUP98結合導致NSD1異常定位的易位也被觀察到。值得注意的是,包括EZH2和組蛋白H1在內的其他表觀遺傳調控因子的種系突變會導致類似于TBRS和Sotos的發育障礙。此外,DNMT3A的功能獲得突變導致多梳抑制域的異位DNA高甲基化,最近在小鼠和人類中發現這種突變會導致生長延遲和微頭蓋癌。因此,未來的工作是有必要解析復雜的染色質調控網絡控制的DNA甲基化圖譜橫跨廣闊的常染色體區域在細胞分化和生長的控制機制。
參考文獻:
Weinberg DN, Papillon-Cavanagh S, Chen H, et al. The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape. Nature. 2019;573(7773):281–286. doi:10.1038/s41586-019-1534-3.