2019-08-20
超實用干貨!如何設計qPCR引物來驗證lncRNA測序結果!
在近十余年的生命科學研究中非編碼RNA可謂是火的研究領域之一,從2006年獲得諾貝爾醫學獎的siRNA干擾技術,到近幾年異常火爆的microRNA,再到轉錄調控研究藍海的lncRNA,可謂如火如荼。長非編碼RNA(Long non-coding RNA,lncRNA)是一類長度大于200個核苷酸的非編碼RNA。
與其他非編碼RNA不同,lncRNA可以折疊成復雜的二級結構或更高級結構,有更大的潛能識別蛋白質和靶標。近些年的文獻研究表明,lncRNA參與X染色體沉默,基因組印記以及染色質修飾,轉錄激活,轉錄干擾,核內運輸等多種重要的調控過程。
目前lncRNA根據其在基因組上相對于蛋白編碼基因的位置可以分為五類:antisense lncRNA, overlapping lncRNA, large intergenic noncoding RNA (linc RNA), intronic lncRNA和exonic lncRNA。
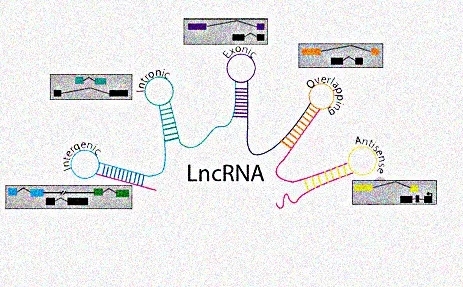
圖源網絡侵刪
在細胞核內的lncRNAs,它們的作用主要是通過引導染色質修飾蛋白(eg.多梳抑制復合物PRC2, 組蛋白甲基轉移酶H3K9)到特定的基因組位點。根據目標位點的不同分為cis-acting lncRNAs和trans-acting lncRNAs。cis-acting lncRNAs控制在它們轉錄位點附近或者同一染色體上長距離的基因的表達。然而trans-acting lncRNAs可以抑制或激活獨立位點的基因表達。盡管目前科研人員提出不同的識別機制,但是這兩種lncRNAs的作用定位機制仍然沒有被完全解釋,尤其是關于cis-acting lncRNAs如何保持它們的轉錄位點和trans-acting lncRNAs如何找到遠距離的目標位點。
同時,許多lncRNAs介導的基因調控機制在細胞質中被發現。在細胞質內的lncRNAs,它們的序列與來自同一染色體位點或獨立位點的轉錄本互補。它們通過互補配對來識別目標位點,從而也能調控蛋白質的翻譯過程。同樣,lncRNAs能增強和降低目標mRNA的穩定性。另一種特殊的lncRNA作用方式是作為競爭性內源RNA(ceRNAs),通過結合或隔離miRNAs來防止目標mRNA的抑制。這代表了一種新的RNA調控回路,不同類型的RNA(編碼和非編碼)都可以相互交流通過競爭共享的miRNAs。
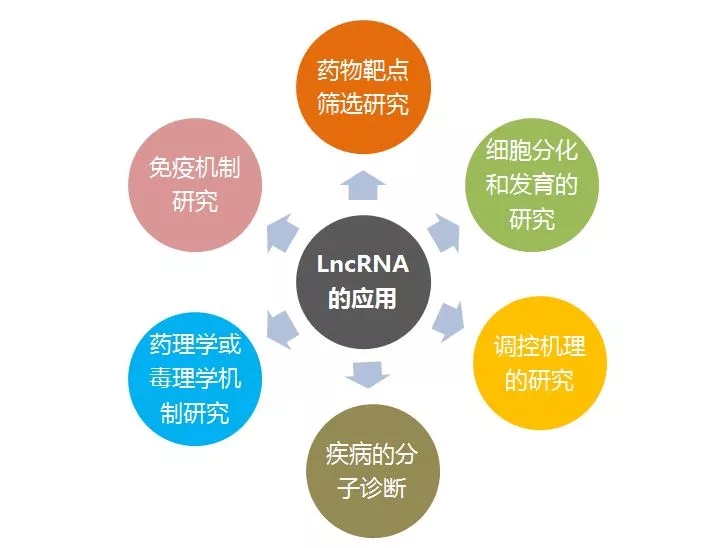
LncRNA的應用
目前,越來越多關于lncRNA研究的文獻出現在Nature、Science、Cell等頂級學術期刊上,研究內容也涉及多個領域,如腫瘤發生,細胞分化,全能性等。越來越多的研究者開始關注lncRNA在生命活動中的重要作用,借助lncRNA高通量測序技術,未來在各領域會有更多的lncRNA調控機制被深入全面地解析。
LncRNA測序技術??
LncRNA測序是研究有參考基因組物種的特定組織或細胞在某個特定時期轉錄出的所有lncRNA和mRNA,所以lncRNA測序既包含對lncRNA的分析也包含了對mRNA的分析。LncRNA測序要滿足的兩個必要條件:1)必須有參考基因組,常見的包括人、小鼠、豬、擬南芥、玉米等;2)有相應的核糖體去除試劑盒。因為lncRNA建庫采用去核糖體建庫方式,文庫中會包含lncRNA,mRNA和其他RNA,所以推薦12G的clean data/樣品,如果希望通過lncRNA測序數據分析circRNA,則需要更多的數據量15-20G。派森諾有專業的實驗人員,嚴格的質量檢控,確保我們的數據真實可靠,為您提供優質的測序服務。
分析結果展示圖
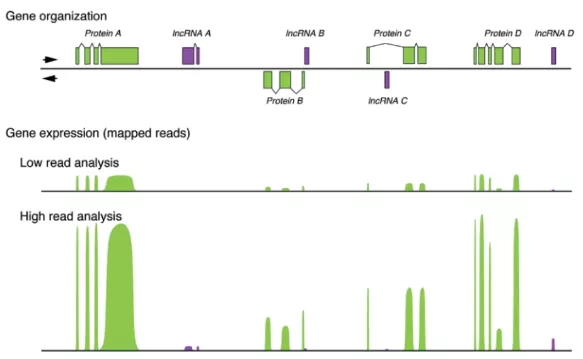
圖1:IGV顯示的基因結構及表達圖
圖2:表達量分布圖
圖3:lncRNA和miRNA的聯合分析
lncRNA測序后的qPCR驗證
在做完測序之后,大家都會用RT-qPCR來驗證測序結果的可靠性。但是很多人會對這些問題有困擾,選哪個lncRNA?變化倍數大的?表達量高的?選lncRNA的哪段設計引物?其它基因有重疊怎么辦?下面我們就來為大家梳理一下做qPCR定量實驗來驗證lncRNA測序的幾個關鍵點:
1. 用和測序同一批次的RNA樣品做RT-qPCR,最好是同一管RNA(如果是由公司提取RNA,可以返樣);如果要重提,則要用和測序樣品同一批次的細胞或同一塊組織。
2. 最好選擇基因間的lncRNA, 其次選擇位于其他基因intron區域的lncRNA,不能選與其他基因exon重疊的lncRNA,否則,RT-qPCR結果就混合了兩個基因的表達量,從而導致實驗誤差較大。
3. 表達量高的lncRNA優于表達量低的lncRNA,更容易做RT-qPCR,Ct值更低,結果更可靠。
4. RNA-seq計算lncRNA表達量和篩選差異基因時,用的是lncRNA全長reads count的總和,不代表每個區段都有表達或表達差異。因此,我們選擇在組間有顯著表達差異的lncRNA,利用IGV程序可以看到哪個區段表達量峰高,從而針對這個區段進行引物設計做qPCR,能保證萬無一失。
最后,由于測序和RT-qPCR是兩種技術平臺它們的原理也不同,所以RNA-Seq和RT-qPCR計算出來的變化倍數不可比,只要變化趨勢相同就算結果一致。


