表觀遺傳學(xué)之組蛋白修飾-簡(jiǎn)介與案例(一)
2024-09-25
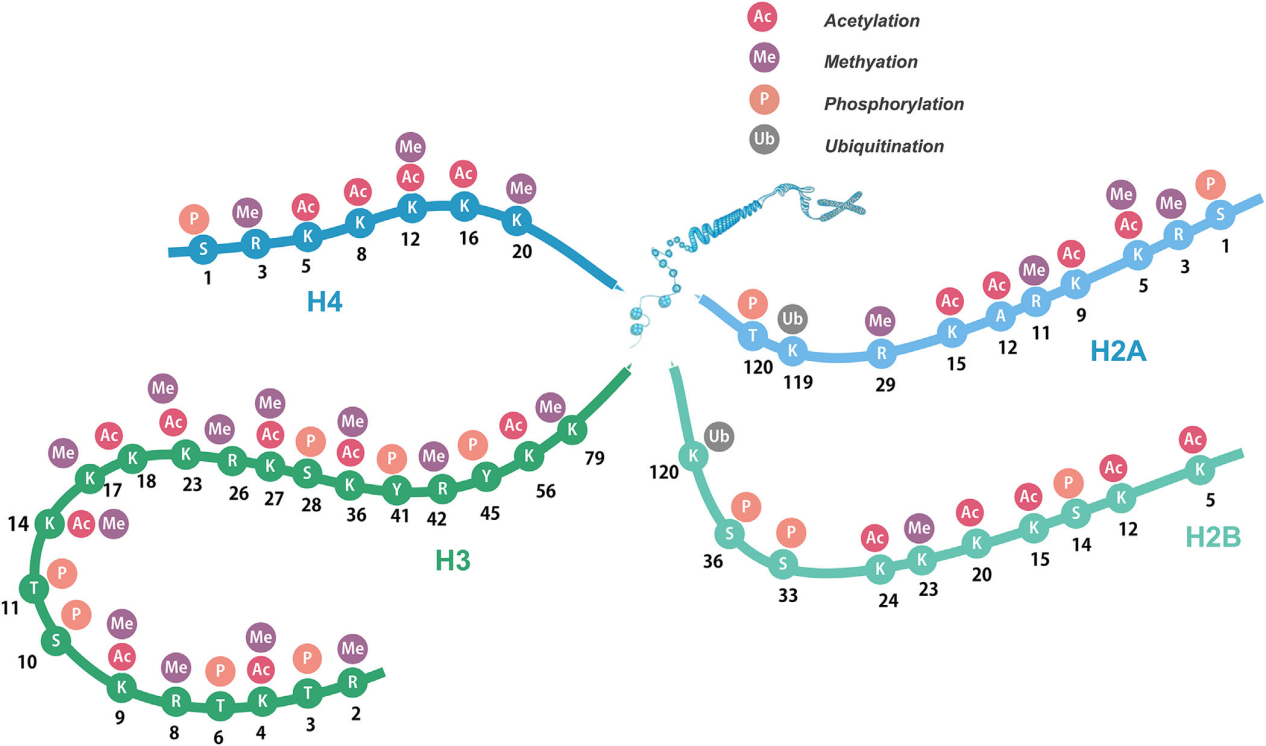
翻譯后修飾 (PTM) 屬于表觀遺傳學(xué)領(lǐng)域,它不會(huì)改變 DNA 序列,但可以改變基因表達(dá)和功能水平,這為許多生命現(xiàn)象提供了新的解釋。組蛋白是真核生物體細(xì)胞染色質(zhì)中的一種堿性蛋白質(zhì),主要分成5類,分別稱為H1、H2A、H2B、H3和H4。
組蛋白可以通過(guò)多種方式進(jìn)行修飾,最常見(jiàn)的包括甲基化、乙酰化、磷酸化和泛素化。隨著高靈敏度質(zhì)譜技術(shù)的發(fā)展,近幾十年來(lái)發(fā)現(xiàn)了各種新的組蛋白酰化標(biāo)志物,如丙二酰化、巴豆酰化、丙酰化、丁酰化和乳酸化等,這些組蛋白氨基末端的多樣化修飾擴(kuò)展了遺傳密碼,共同構(gòu)成“組蛋白密碼”。
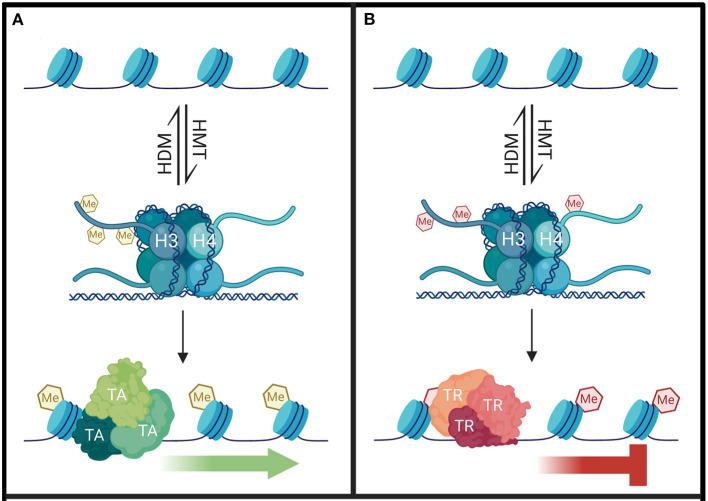
組蛋白修飾的組合與生物學(xué)功能之間的關(guān)系可以用作重要的表觀遺傳標(biāo)記。同一組蛋白殘基的甲基化和去甲基化、乙酰化和去乙酰化、磷酸化和去磷酸化,甚至不同組蛋白殘基之間的甲基化和乙酰化相互配合或拮抗,形成一個(gè)復(fù)雜的網(wǎng)絡(luò)。因此,透徹了解組蛋白PTM在細(xì)胞生命活動(dòng)中的作用對(duì)于預(yù)防和治療人類疾病非常重要。接下來(lái)小派將對(duì)幾種常見(jiàn)組蛋白修飾進(jìn)行介紹。
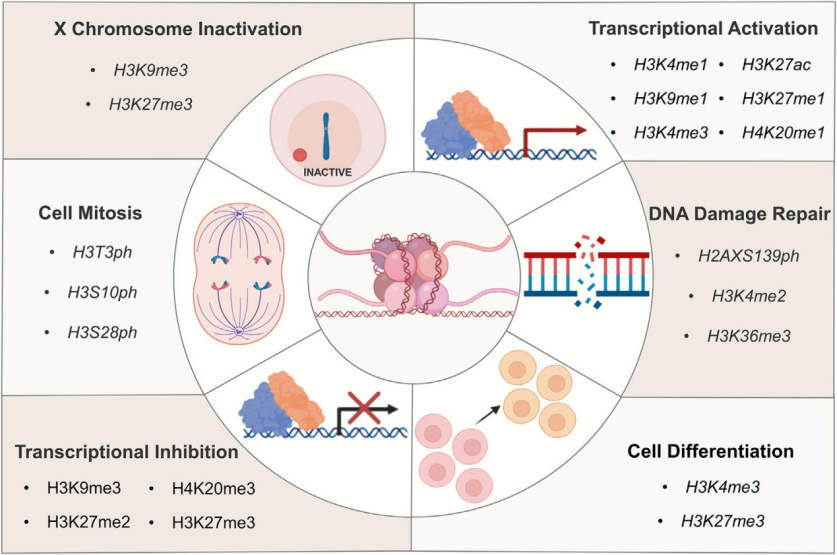
組蛋白修飾介導(dǎo)的多種生物學(xué)效應(yīng)
乙酰化修飾是進(jìn)化上保守且可逆的 PTM,是最早描述的組蛋白修飾之一。其中賴氨酸乙酰化修飾由 Allfrey 等人 (1964) 首次在組蛋白中發(fā)現(xiàn),并以深刻的洞察力提出了這種蛋白質(zhì)修飾在轉(zhuǎn)錄調(diào)控中的調(diào)節(jié)作用。
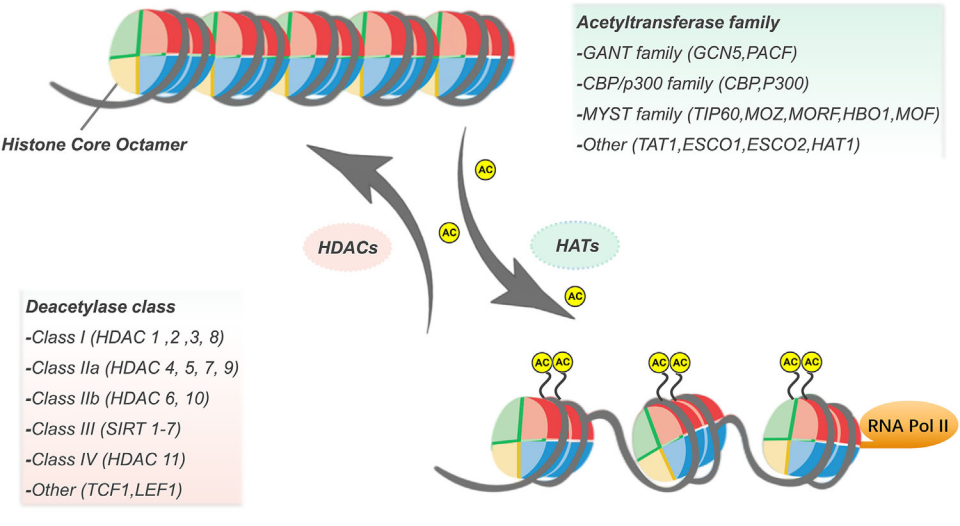
乙酰化修飾廣泛存在于原核和真核生物中。組蛋白乙酰轉(zhuǎn)移酶(HAT)調(diào)節(jié)組蛋白乙酰化,由乙酰轉(zhuǎn)移酶將乙酰輔酶 A 上的乙酰基轉(zhuǎn)移到組蛋白的賴氨酸殘基上,使賴氨酸殘基上的電荷中和。這導(dǎo)致組蛋白與 DNA 的結(jié)合松散,染色質(zhì)結(jié)構(gòu)的松散有利于轉(zhuǎn)錄因子或轉(zhuǎn)錄調(diào)節(jié)蛋白結(jié)合到 DNA 上,進(jìn)而促進(jìn)了基因的轉(zhuǎn)錄和表達(dá),因此,組蛋白乙酰化通常被認(rèn)為是一種活性組蛋白標(biāo)記。目前已鑒定出 13 個(gè) HAT,由三個(gè)主要家族組成:CBP/p300、GCN5 和 MYST 乙酰轉(zhuǎn)移酶家族。而組蛋白去乙酰化酶(HDAC)主要功能是從組蛋白和非組蛋白的賴氨酸殘基中催化去除乙酰基官能團(tuán),從而維持動(dòng)態(tài)平衡。HDAC 使組蛋白去乙酰化,強(qiáng)烈附著在帶負(fù)電荷的 DNA 上,使染色質(zhì)密集卷積,并抑制基因轉(zhuǎn)錄。人類基因組包含 18 個(gè) HDAC,分為Rpd3 樣蛋白、Hda1 樣蛋白、Sir2樣蛋白和HDAC11。
組蛋白乙酰化水平受 HDAC和 HAT的共同調(diào)節(jié)
H3K27ac主要出現(xiàn)在組蛋白H3的第27位賴氨酸殘基上。起通常與基因的轉(zhuǎn)錄激活狀態(tài)相關(guān),特別是在增強(qiáng)子和啟動(dòng)子區(qū)域。H3K27ac的富集通常標(biāo)志著活躍的增強(qiáng)子,這些增強(qiáng)子是調(diào)控基因表達(dá)的重要元件,能夠影響基因的時(shí)空特異性表達(dá)。
題目:A local tumor microenvironment acquired super-enhancer induces an oncogenic driver in colorectal carcinoma
局部腫瘤微環(huán)境獲得性超增強(qiáng)子誘導(dǎo)結(jié)直腸癌的致癌驅(qū)動(dòng)因素
發(fā)表期刊:Nature Communications
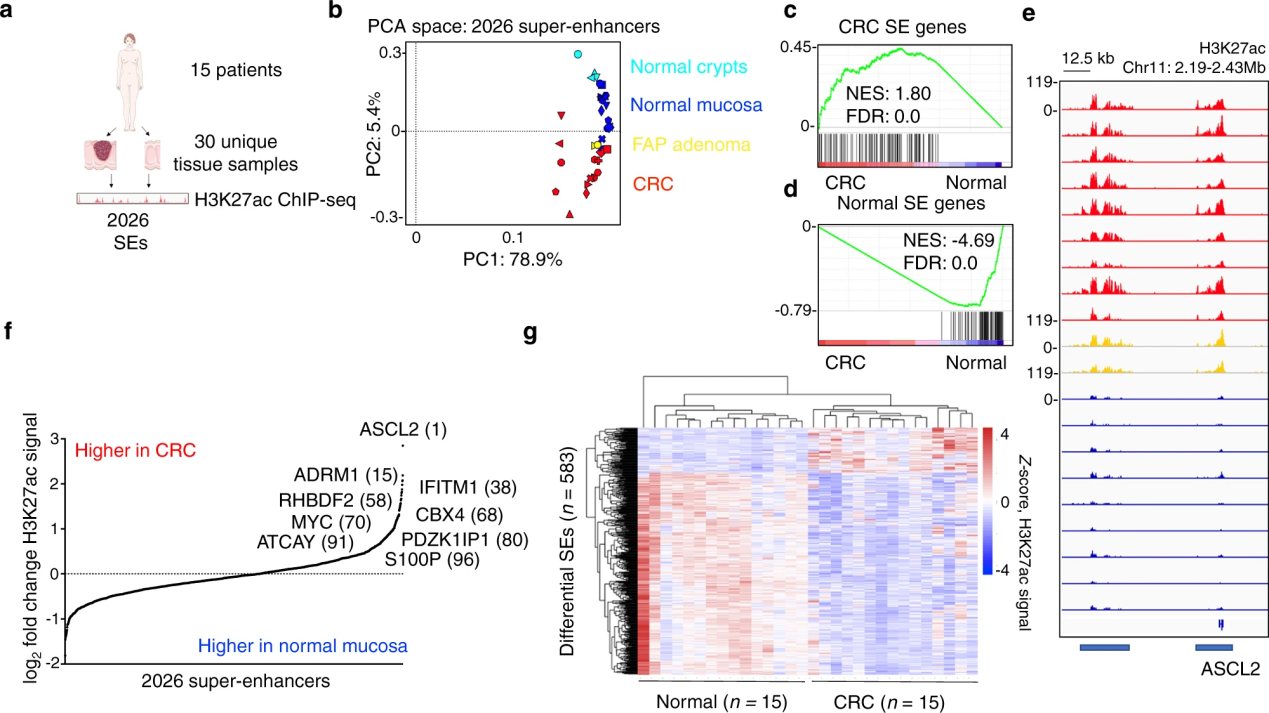
本文探討了在結(jié)直腸癌(CRC)中,腫瘤微環(huán)境如何通過(guò)表觀遺傳學(xué)修飾影響基因表達(dá),特別是通過(guò)H3K27ac修飾。研究發(fā)現(xiàn)腫瘤微環(huán)境中的炎癥因子能夠誘導(dǎo)特定的超級(jí)增強(qiáng)子(SEs),特別是PDZK1IP1基因的超級(jí)增強(qiáng)子,從而促進(jìn)腫瘤生長(zhǎng)。研究表明,PDZK1IP1通過(guò)戊糖磷酸途徑增強(qiáng)了CRC細(xì)胞的還原能力,提高了腫瘤細(xì)胞在氧化條件下的生長(zhǎng)效率。此外,研究發(fā)現(xiàn)腫瘤微環(huán)境中的炎癥信號(hào)通過(guò)NF-κB和STAT3轉(zhuǎn)錄因子直接調(diào)控PDZK1IP1超級(jí)增強(qiáng)子的活性。這些發(fā)現(xiàn)強(qiáng)調(diào)了表觀基因組分析在原始腫瘤樣本中的重要性,并為開(kāi)發(fā)針對(duì)腫瘤微環(huán)境的治療策略提供了新的視角。
結(jié)直腸癌患者中反復(fù)失調(diào)的超級(jí)增強(qiáng)子
1999年首次描述了組蛋白甲基化與DNA轉(zhuǎn)錄之間的聯(lián)系,但與組蛋白乙酰化不同的是,隨后很快就鑒定出了特定的組蛋白甲基轉(zhuǎn)移酶(HMTs)。組蛋白甲基化是主要的轉(zhuǎn)錄后修飾之一,其發(fā)生在H3和H4組蛋白N端賴氨酸或精氨酸殘基上。目前已鑒定出 24 個(gè)甲基化位點(diǎn),其中 17 個(gè)位于賴氨酸,7 個(gè)位于精氨酸。這些組蛋白甲基化修飾通過(guò)募集不同的轉(zhuǎn)錄因子來(lái)調(diào)節(jié)基因表達(dá),而不直接改變?nèi)旧|(zhì)結(jié)構(gòu)。
甲基化主要由 HMT 催化,可分為組蛋白賴氨酸甲基轉(zhuǎn)移酶(KMT )和組蛋白精氨酸甲基轉(zhuǎn)移酶(PRMT)。賴氨酸殘基可以發(fā)生單、雙或三甲基化修飾,而精氨酸殘基則只發(fā)生單和不對(duì)稱雙甲基化修飾,其中組蛋白H3K4和H3K9是常見(jiàn)的兩個(gè)修飾位點(diǎn)。而組蛋白去甲基化酶,大致分為賴氨酸特異性去甲基化酶LSD和Jumonji C(JMJC)兩個(gè)家族。LSD1是第一個(gè)報(bào)道的組蛋白賴氨酸去甲基化酶。它催化H3K4me1/2和H3K9me1/2 的去甲基化,特異性去除 H3K4中的單甲基和二甲基化修飾。而JMJC家族能去除賴氨酸三甲基化的修飾。
組蛋白甲基化招募不同的轉(zhuǎn)錄因子調(diào)控基因表達(dá)
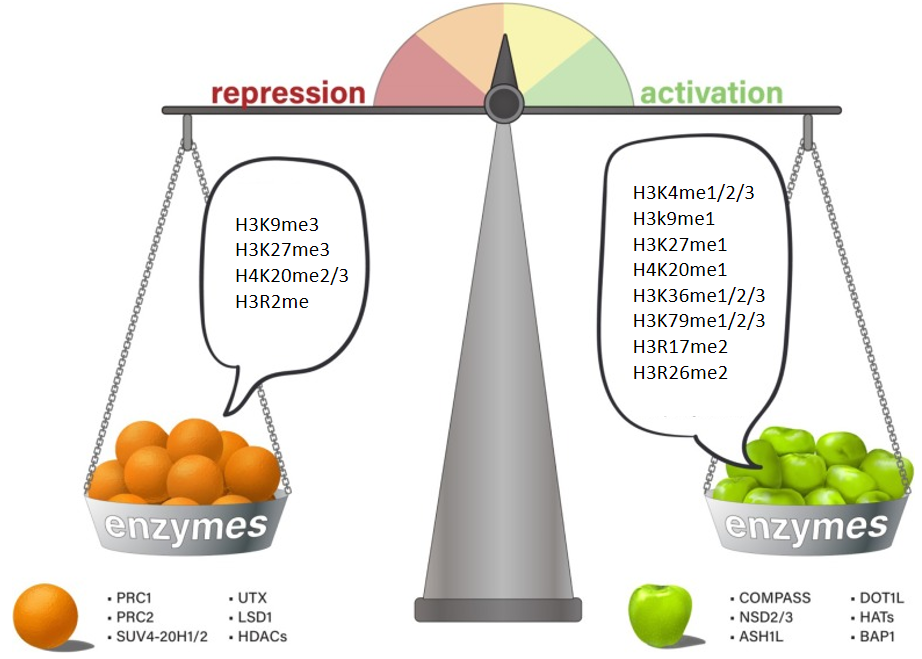
組蛋白甲基化可參與染色質(zhì)結(jié)構(gòu)的維持與基因表達(dá)的沉默或激活。一般來(lái)說(shuō),精氨酸殘基的甲基化能激活基因的表達(dá),而賴氨酸甲基化根據(jù)不同的甲基化位點(diǎn)發(fā)揮轉(zhuǎn)錄激活或抑制的功能,如H3K4和H3K36位點(diǎn)發(fā)生的甲基化及H3K27的單甲基化能激活基因的轉(zhuǎn)錄,而H3K9、H3K79、H4K20位點(diǎn)的甲基化及H3K27的雙甲基化和三甲基化能抑制靶基因的轉(zhuǎn)錄。H3K9me3、H3K27me3、H3K36me3、H4K20me3是胃癌、肝癌、乳腺癌、胰腺癌、卵巢癌和結(jié)腸癌等重要的腫瘤標(biāo)志物。H3K9me2、H3K9me3和H3K27me3的表達(dá)模式與臨床病理特征密切相關(guān),可能是胃癌病人生存評(píng)價(jià)的獨(dú)立危險(xiǎn)因子。
H3K4me3是組蛋白H3第四位賴氨酸在甲基轉(zhuǎn)移酶 (HMT) 催化下發(fā)生三甲基化。H3K4me3是最重要的甲基化修飾之一,真核生物中該修飾在轉(zhuǎn)錄起始位點(diǎn)普遍發(fā)生,通常在基因的啟動(dòng)子附近富集,并且與基因的轉(zhuǎn)錄相關(guān),是表觀遺傳學(xué)一個(gè)標(biāo)志,其水平可以反映出轉(zhuǎn)錄的程度,在基因的轉(zhuǎn)錄中有著重要的作用。
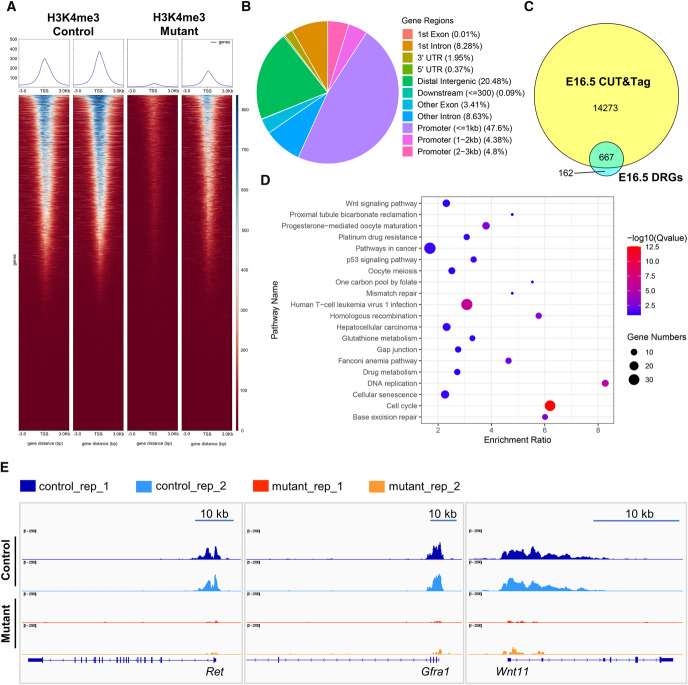
題目:ASH2L Controls Ureteric Bud Morphogenesis via Regulation of RET/GFRA1 Signaling Activity in a Mouse Model
ASH2L通過(guò)調(diào)節(jié)RET/GFRA1信號(hào)活性控制小鼠模型中輸尿管芽的形態(tài)發(fā)生
發(fā)表期刊:Journal of the American Society of Nephrology
本文發(fā)現(xiàn)ASH2L缺失可導(dǎo)致新生小鼠CAKUT樣表型,主要涉及出生時(shí)腎發(fā)育不良。這些表型主要源于胚胎發(fā)育期UB發(fā)育衍生物的分支減少。轉(zhuǎn)錄組和CUT&Tag聯(lián)合分析發(fā)現(xiàn),UB特異性ASH2L敲除小鼠UB細(xì)胞中RET/GFRA1信號(hào)通路核心組分如Ret、Gfra1、Wnt11等基因的表達(dá)顯著減少,ASH2L缺失所導(dǎo)致的啟動(dòng)子區(qū)域H3K4me3修飾減少導(dǎo)致了RET/GFRA1信號(hào)通路相關(guān)基因表達(dá)減少。該研究結(jié)果不僅有助于從表觀遺傳修飾的角度更好地理解胚胎腎臟發(fā)生、發(fā)育的精細(xì)調(diào)控機(jī)制,同時(shí)也揭示了表觀遺傳修飾改變與CAKUT發(fā)病機(jī)制內(nèi)在聯(lián)系,為CAKUT的預(yù)防和治療提供了靶點(diǎn)研究思路。
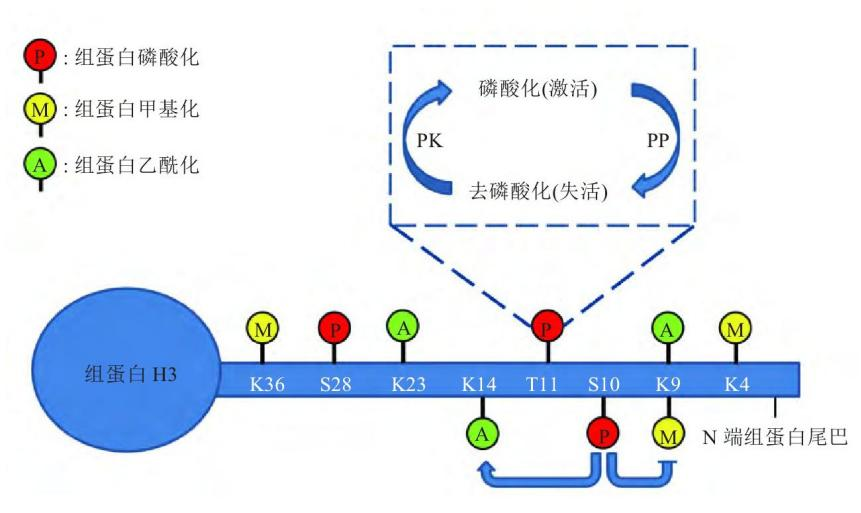
磷酸化是最常見(jiàn)的翻譯后修飾之一,組蛋白磷酸化修飾大部分發(fā)生在絲氨酸(S)和蘇氨酸(T)殘基上,也可發(fā)生在酪氨酸(Y)殘基上。組蛋白磷酸化與組蛋白去磷酸化過(guò)程處于動(dòng)態(tài)平衡,由蛋白激酶(PK)和蛋白磷酸酶(PP) 共同調(diào)控,蛋白激酶催化組蛋白尾端的氨基酸殘基與磷酸基團(tuán)結(jié)合,與基因轉(zhuǎn)錄活化有關(guān);而蛋白磷酸酶的作用則相反,脫去氨基酸殘基上的磷酸基團(tuán),抑制基因轉(zhuǎn)錄的起始與表達(dá)。組蛋白磷酸化修飾影響染色體的結(jié)構(gòu)和功能有兩種可能的機(jī)制:第一,磷酸基團(tuán)的負(fù)電荷中和了組蛋白所攜帶的正電荷,這造成組蛋白與DNA之間的親和力下降;第二,磷酸化修飾有利于組蛋白與蛋白質(zhì)的識(shí)別,促進(jìn)蛋白質(zhì)復(fù)合物的招募或者相互作用
組蛋白磷酸化參與廣泛的細(xì)胞過(guò)程,包括轉(zhuǎn)錄調(diào)控、細(xì)胞凋亡、細(xì)胞周期進(jìn)程、DNA 修復(fù)、染色體濃縮和發(fā)育基因調(diào)控。并且組蛋白不同位點(diǎn)翻譯后修飾存在交互作用,如 H3S10磷酸化促進(jìn)H3K14乙酰化的同時(shí)可抑制H3K9甲基化,更利于基因轉(zhuǎn)錄的調(diào)控。
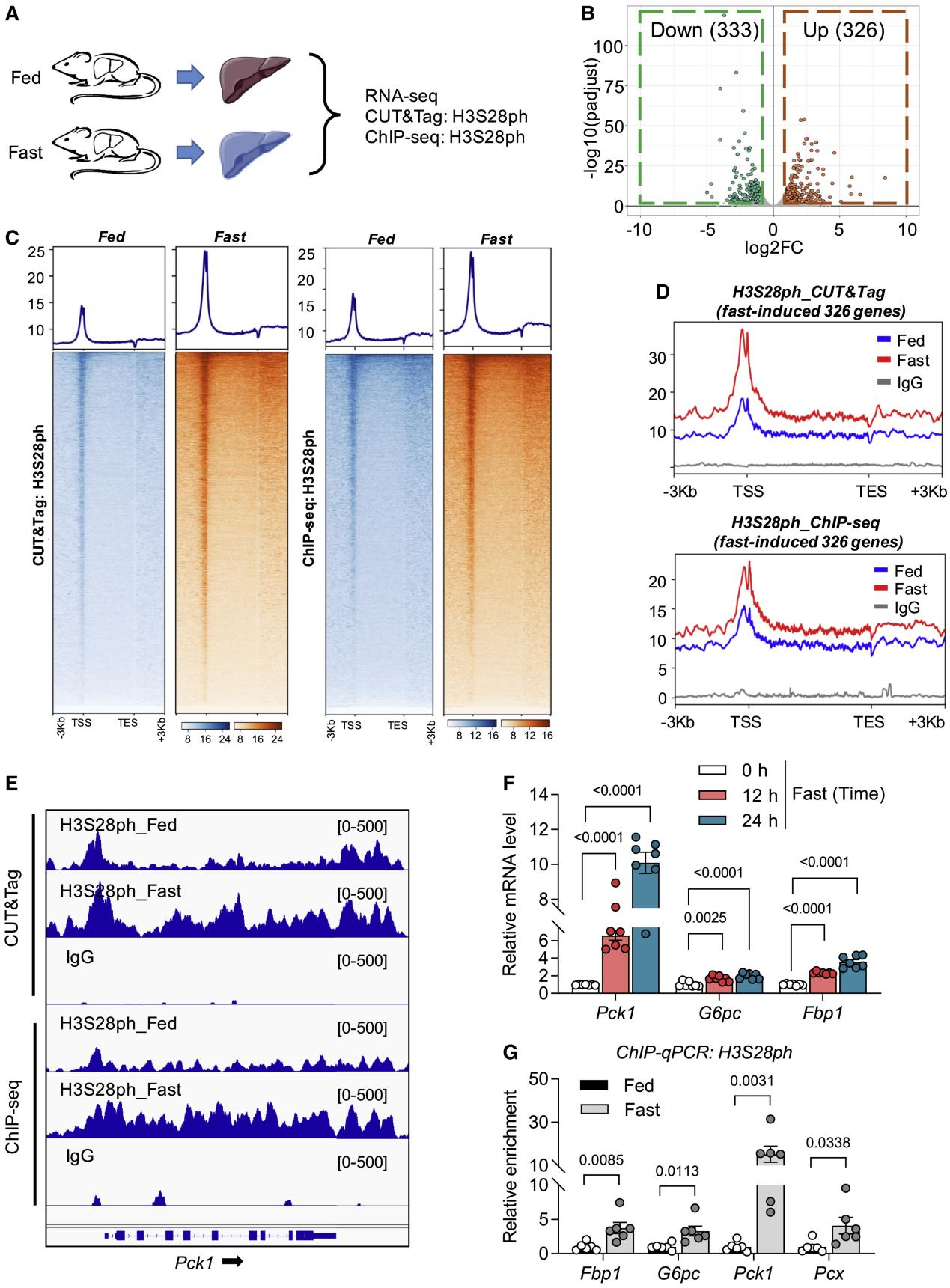
組蛋白H3的第28位絲氨酸磷酸化(H3S28ph)是一種重要的表觀遺傳修飾。它在細(xì)胞對(duì)環(huán)境變化的響應(yīng)中起著關(guān)鍵作用,特別是在肝臟糖異生的調(diào)控中。此外,H3S28ph在細(xì)胞周期調(diào)控中也起著重要作用,在有絲分裂期間,H3S28ph與染色體的凝聚和分離密切相關(guān);在轉(zhuǎn)錄調(diào)控方面,H3S28ph與其他組蛋白修飾存在交互作用。
題目:Histone phosphorylation integrates the hepatic glucagon-PKA-CREB gluconeogenesis program in response to fasting
禁食狀態(tài)下組蛋白磷酸化在整合肝臟胰高血糖素-PKA-CREB糖異生程序
發(fā)表期刊:Molecular Cell
胰高血糖素-PKA信號(hào)通常被認(rèn)為通過(guò)CREB轉(zhuǎn)錄因子控制肝糖異生。本文發(fā)現(xiàn)了該信號(hào)在直接刺激組蛋白磷酸化以調(diào)節(jié)小鼠糖異生基因。在空腹?fàn)顟B(tài)下,CREB 將激活的 PKA 募集到糖異生基因附近的區(qū)域,其中 PKA 磷酸化組蛋白H3絲氨酸28 (H3S28ph)被14-3-3ζ識(shí)別,促進(jìn)RNA聚合酶II的募集和糖異生基因的轉(zhuǎn)錄刺激。在進(jìn)食狀態(tài)下,在糖異生基因附近發(fā)現(xiàn)了更多的 PP2A,它們通過(guò)去磷酸化 H3S28ph 和抑制轉(zhuǎn)錄來(lái)抵消 PKA。當(dāng)肝臟PKA或CREB耗盡時(shí),磷酸化H3S28的異位表達(dá)有效地恢復(fù)了糖異生基因的表達(dá)。這些結(jié)果共同強(qiáng)調(diào)了胰高血糖素-PKA-CREB-H3S28ph 級(jí)聯(lián)反應(yīng)調(diào)節(jié)糖異生,其中激素信號(hào)被傳遞到染色質(zhì),以實(shí)現(xiàn)快速有效的糖異生基因激活。
組蛋白H3S28磷酸化位于快速誘導(dǎo)基因附近