
2024-09-18

當我們做完轉錄組測序之后,往往需要做qPCR來驗證測序結果。這種情況下,基因的選擇、樣品的情況都是成為影響結果的重要因素。今天就讓小派來帶大家深挖下這其中的門道吧!
一、驗證基因的選擇 1、選擇自己感興趣的基因進行驗證,即使其表達倍數可能沒有到達2倍(比如1.5倍); 2、選擇表達量變化幅度較大的基因,比如差異倍數大于兩倍(即fc>2或<0.5); 3、選擇具有統計學差異的基因,比如pvalue<0.05甚至qvalue<0.05(另外如果樣本類型異質性較高且在進行測序時生物學重復數偏低情況下,即使p值大于0.05,在其表達量尚可且變化幅度尚可的情況下也是可以考慮的); 4、選擇表達量比較高的基因,在比較的樣本組中,至少有一組樣本的基因表達豐度(FPKM值)平均值大于10(不是絕對標準); 5、建議選擇生物學重復樣本間一致性較高的基因(對于異質性較高的樣本,基因在生物學重復樣本間可能也有明顯差異,但差異倍數是實驗組和對照組表達量平均值相除,一些異常表達量可能對差異倍數產生影響); 6、盡量選擇多一些基因(15-30個)進行驗證,看總體差異趨勢情況。
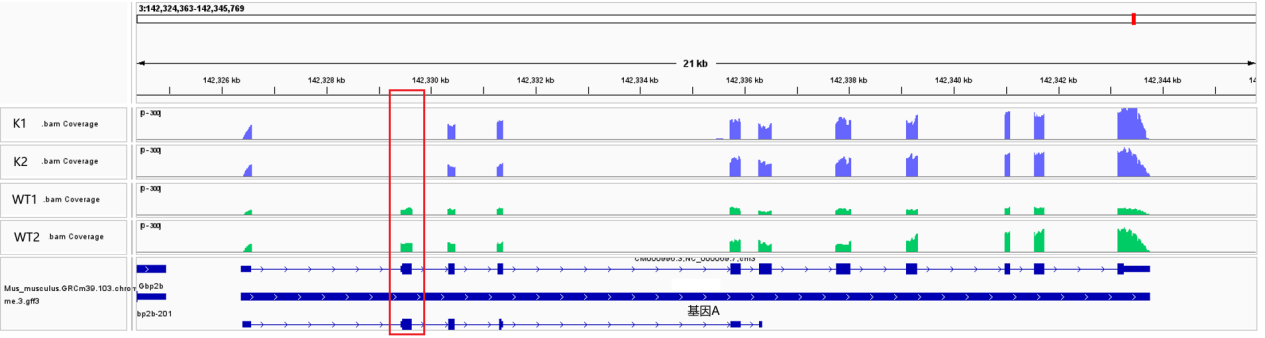
二、轉錄組和qPCR一致性 首先,我們需要對轉錄組和qPCR一致性有一個合理預期:這兩個實驗方法本身存在差異,因此存在一定程度的不一致性(約30-40%)是正常的情況[1]。在Huang J等人的研究中,出現轉錄組和qPCR結果的不一樣(甚至趨勢相反的情況),文章也對這種情況進行了探討[2]。 因此在這里小派總結了幾個可能影響轉錄組和qPCR一致性的原因: 1、樣本是否為同一批次: 因為RNA的表達具有時空特異性,不同批次處理的樣本之間本身可能存在一定的差異,所以做qPCR驗證的時候建議是直接用轉錄組測序返樣的RNA。并且當我們在轉錄組測序中發現非常明顯的離群樣本時候,避免這種個體特異性導致結果不準確,可以在做轉錄組分析和后續驗證時候剔除這種離群樣本。 2、比較組順序是否反了: 在轉錄組分析中,文章中普遍存在兩種不同的比較組命名方法,即 對照組 vs 處理組、處理組 vs 對照組,在分析差異的時候都是用 處理組/對照組 的。這兩種命名上存在差異,可能是會導致差異的理解存在不同情況,在小派這里轉錄組項目的命名都是 對照組 vs 處理組。 3、qPCR操作是否規范: qPCR儀器的靈敏度不僅取決于儀器本身的技術規格,還受到實驗操作規范性的影響。設置預實驗,通過擴增曲線和溶解曲線來判斷引物是否合適,是非常重要的步驟;并且在正式實驗中,重復的設置也是不可缺少的一環。 4、引物設計是否合理: 在真核生物中,基因可能通過不同的剪切形式產生多條轉錄本,而各轉錄本的差異變化趨勢也可能是不一致的,因此我們需要明確我們做qPCR是針對基因還是針對特定的轉錄本去驗證。常規轉錄組分析是針對于整個基因定量的,因此可以針對多個轉錄本共有的外顯子去設計引物,從而驗證基因的表達;如果是對特定轉錄本分析的話,可能需要找到整個轉錄本特有的外顯子部分設計引物驗證。另一方面,設計完引物后,可以通過NCBI的Primer blast去看看設計的引物是否在基因組里是特異性擴增的。 5、基因選擇是否合適: 驗證的基因一般建議選擇表達豐度較高的,因為對于表達豐度非常低的基因來說,本身測序和qPCR對其的定量就不一定非常可靠。另外對于基因組相同位置存在多個基因(例如相同位置存在正負2個方向的基因)或在基因組中存在多拷貝的基因,也并不建議選擇去驗證。選擇的內參基因在不同樣品里是否穩定表達,是另一個影響qPCR相對定量結果的關鍵因素。 6、兩種技術本身存在差異: 轉錄組測序是基于檢測樣品里所有基因整體上的表達情況,qPCR是特異性設計引物對基因的局部區域做相對定量的,兩者的技術原理是存在一定不同的,所以轉錄組和qPCR確實有可能存在并沒有非常一致的情況的,一般來說主要看大部分基因的趨勢一致就行的。 備注(一種比較特別的情況): 為什么敲除基因A的2號外顯子后,K組的表達比WT組還高了? qPCR驗證的時候一般是針對敲除部分去檢測,所以能很好的驗證敲除情況。而常規轉錄組是對整個基因定量的,雖然敲除了2號外顯子,但其它外顯子的轉錄層面可能并沒有受到限制,并且由于劑量效應的影響,敲除了2號外顯子后,可能刺激了其它外顯子的表達,因此從轉錄組測序的結果來看可能就出來了敲除組的這個基因表達甚至相比對照上升了。 雖然是從轉錄組測序來看這個表達沒有下調,但是敲除后,翻譯成蛋白可能受到阻礙,因此結合qPCR的驗證和IGV圖,是可以充分表明敲除是沒問題的哈。 IGV是使用可以參考教程:https://mp.weixin.qq.com/s/7-_l5aQ72p8vvk2Ot4gfZg
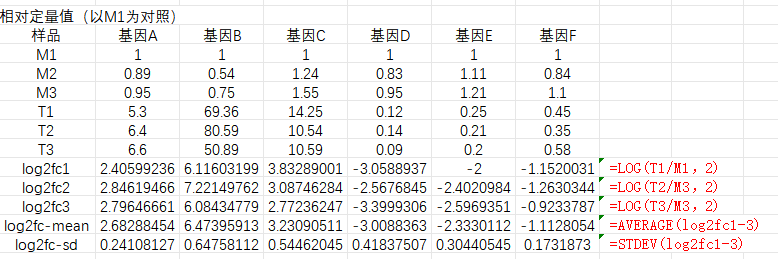
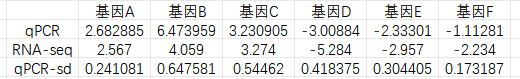
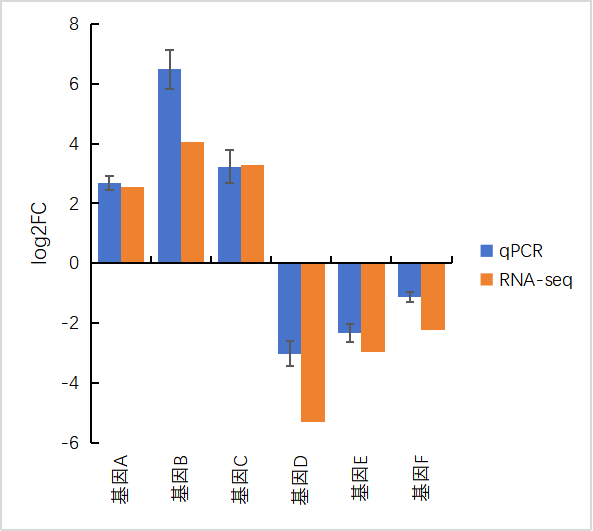
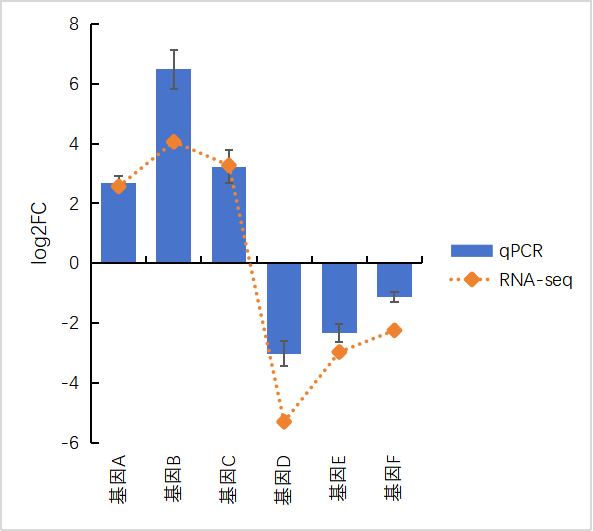
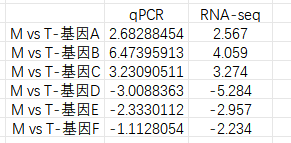
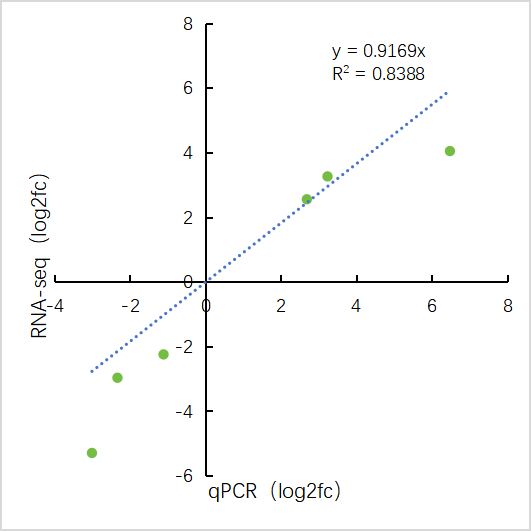
三、轉錄組和qPCR結果可視化 做完qPCR后,我們會得到基因在樣品里的相對定量結果(一般使用2-??Ct),而在轉錄組中也有這些基因log2fc結果,如下: 針對于這兩個數據的展示,通常有以下幾種圖: 1、柱狀圖: a.基于qPCR的相對定量結果,引用excel的函數(log、average、stdev)求得log2fc和標準差; b.將qPCR和轉錄組的數據整理(qPCR和RNA-seq的log2fc、qPCR的標準差)成表; C.基于前3列用excel繪制柱狀圖,然后添加qPCR的誤差線(自定義設置:±標準差)。 2、柱狀圖+折現圖: a.基于1b里整理完的數據,在excel里插入組合圖; B.給柱狀圖增加誤差線,調整下,出圖。 3、散點圖(針對多比較組的結果,展示的更方便): a.基于1a里計算的qPCA的log2fc結果,與轉錄組的log2fc結果一一對應的整理數據; b.選中2列log2fc結果,用excel繪制散點圖,添加趨勢線(可以顯示公式和R平方)。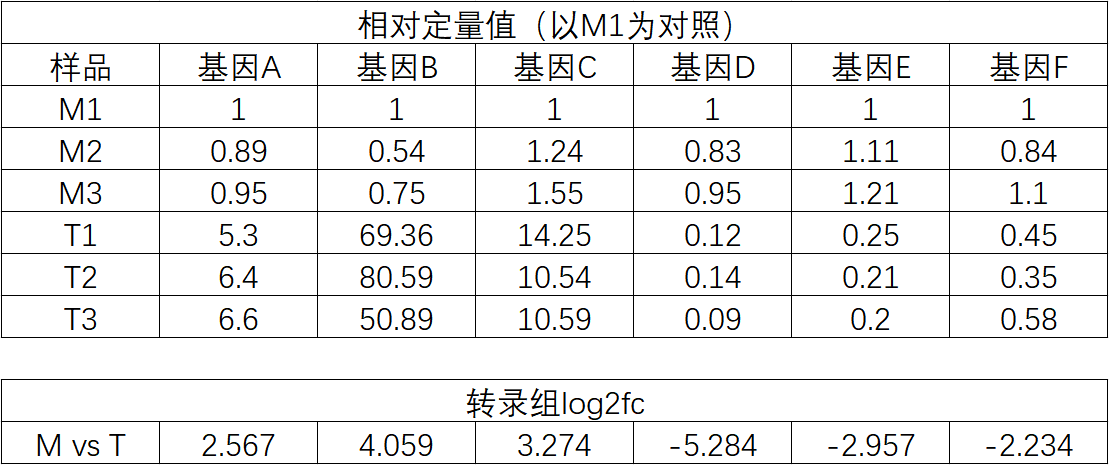
[1]Chen X, Yang X, Xie J, Ding W, Li Y, Yue Y, Wang L. Biochemical and Comparative Transcriptome Analyses Reveal Key Genes Involved in Major Metabolic Regulation Related to Colored Leaf Formation in Osmanthus fragrans 'Yinbi Shuanghui' during Development. Biomolecules. 2020 Apr 4;10(4):549. [2]Huang J, Zhou Q. Gene Biomarkers Related to Th17 Cells in Macular Edema of Diabetic Retinopathy: Cutting-Edge Comprehensive Bioinformatics Analysis and In Vivo Validation. Front Immunol. 2022 May 16;13:858972.