
2024-09-09

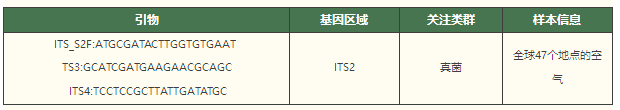
eDNA(environmenta DNA)是指從環境樣品(水體、土壤、沉積物、空氣、混合物等)中提取物種的DNA,區別于傳統從單物種樣品中提取的DNA[1,2],是各種生物的DNA混合物[1,2]。而空氣樣本的收集在生態監測中一直有很大的挑戰性,尤其是在檢測空氣中極微量的DNA時。相比于土壤、水體或沉積物的采集,空氣樣本難以精確控制其來源和組成,且容易受到外界環境的干擾,如風速、濕度、溫度等因素的影響。即便在理想的采樣條件下,空氣中的DNA通常也極其稀少且易于降解,這給后續的DNA提取和分析帶來了困難。 空氣濾膜的出現通過使用高效的空氣過濾裝置,將空氣中的顆粒物(包括微生物、花粉、皮屑和其他含有DNA的物質)捕獲在濾膜上,為后續的環境DNA分析奠定了基礎。空氣濾膜eDNA研究的基本原理是通過空氣過濾裝置捕獲空氣中的顆粒物,這些顆粒物可能含有來自生物體的DNA片段。eDNA擴增子技術通過從空氣濾膜中提取環境DNA,結合高通量測序技術,對這些DNA進行擴增與鑒定分析,從而確定空氣中的生物物種組成。eDNA擴增子測序能夠對生態群落進行大規模監測和表征,有效的彌補了傳統監測方法的不足,為生態研究提供了更加全面和敏捷的手段[3,4]。生物體的監測不再只依賴于物理觀察,而是通過其DNA的存在或豐度進行間接監測,這使得可以同時監測成百上千個物種或分類群體,極大提高了監測的廣度和效率[3]。這種技術不僅在監測生物多樣性方面具有顯著優勢,還能夠識別空氣中潛在的病原體,為環境保護與公共衛生提供科學依據。通過定期監測空氣樣本中的eDNA,可以跟蹤物種遷移、季節性變化以及環境壓力對生物群落的影響。此外,這種技術在研究氣候變化、環境污染和生態修復等領域也展現出巨大的潛力。 真菌是生命中最具多樣性和生態重要性的界之一,然而,真菌的分布范圍和影響其分布的生態機制在很大程度上仍然是未知的[6,7]。今年(2024)7月份,Abrego等人在Nature主刊上發表了其關于真菌的研究進展[8]。文章從全球47個地點收集了空氣中大于1μm的顆粒,揭示了真菌物種豐富度和群落組成在空間和季節上的動態變化過程。 Lynggaard等人在2022年[9]和2024[10]年分別在Current Biology和Mol Ecol Resour上發表了關于動物園和森林中空氣eDNA的研究成果,來探索哺乳動物和脊椎動物的多樣性。為監測陸地生態系統中的哺乳動物和脊椎動物群落提供了一種高效的工具,這對于理解生物多樣性和進行生態系統管理至關重要。這兩篇文章用到的是相同的引物,引物詳情如下: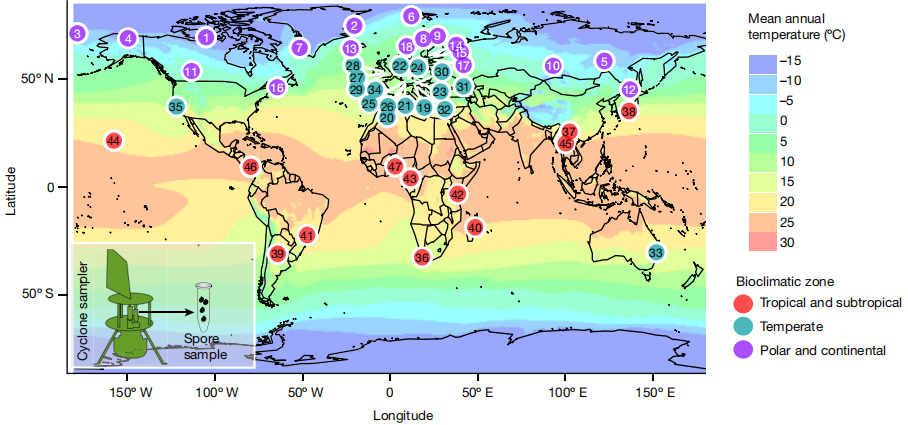
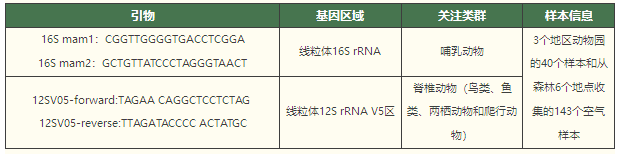
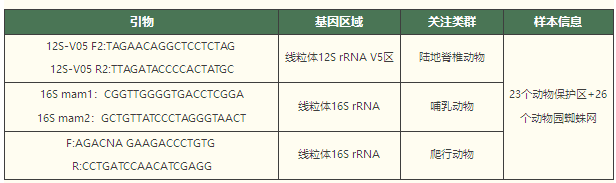
在空氣樣本的研究中,除了空氣濾膜之外,偶爾也會遇到一些有趣的樣本。比如Newton等人今年(2024年)在iScience發表了一篇關于蜘蛛網樣本的eDNA研究[11],共收集了來自野生動物保護區和動物園的49個蜘蛛網,來探索蜘蛛網能否作為被動生物過濾器來指示環境中的生物多樣性。研究結果表明,蜘蛛網能夠捕捉到來自周圍環境中的多種脊椎動物的eDNA,包括哺乳動物、鳥類、爬行動物和兩棲動物。該文用到的測序引物如下:
空氣樣品采集建議: 1.對于空氣樣本采集,我們建議使用專門的空氣收集儀器,使用時注意對專用采樣儀器的進樣頭、切割頭和膜托等關鍵部位進行清洗。 2.目前主流采樣模式大概分為兩種,一種是無菌濾膜收集方法,另一種是液體撞擊式收集方法。其中無菌濾膜收集方法,可將無菌濾膜置于采樣器中(濾膜材質為玻璃纖維,直徑80mm),空氣流量為100 L/min,采集后用無菌水或PBS緩沖液沖洗濾膜,將濾膜上沉積顆粒物溶于其中,后續對液體12000 r/min離心20min,取沉淀提取DNA即可;另外液體撞擊收集方法,建議用無菌水或者PBS緩沖液作為樣品吸附液,收集完后,對含有空氣微生物的吸附液進行離心或者過濾濃縮的方法提取DNA即可; 3.對于無菌濾膜收集方法,老師可以通過寄送濾膜的形式將收集的空氣微生物樣品運往公司,運輸途中建議干冰寄送; 4.對于液體撞擊收集方法,老師可以通過將吸附液,吸附液的體積不能大于500ml;或者將吸附液過濾后的濾膜寄往公司,過濾的步驟可以參照灌溉水樣的樣本采集流程;樣品運輸建議干冰寄送;
空氣濾膜eDNA研究為生態監測和環境保護提供了一種創新且高效的方法。盡管在樣本收集、污染控制和DNA降解等方面仍然面臨技術挑戰,但我們相信隨著分子生物學技術的進步,空氣eDNA研究在生態研究和公共衛生領域的發展前景會越來越好!
1.Taberlet P, Coissac E, Hajibabaei M et al. Environmental DNA. Molecular Ecology, 2012, 21(8): 1789-1793 2.What's behind the term? Clarifying the terminology and recom-1/mec.15643.Pawlowski J,Apothéloz-Pemet-Gentil L, Altermatt F. Environmental DNA :mendations for its future use in biomonitoring. Molecular Ecology, 2020, 29(22): 4258-4264. 3.J. B. Mihoub et al., Setting temporal baselines for biodiversity: the limits of available monitoring data for capturing the full impact of anthropogenic pressures. Sci Rep 7, 41591 (2017). 4.K. Bohmann et al., Environmental DNA for wildlife biology and biodiversity monitoring. Trends Ecol Evol 29, 358-367 (2014). 5.L. Estes et al., The spatial and temporal domains of modern ecology. Nat Ecol Evol 2, 819-826 (2018). 6. Peay, K. G., Kennedy, P. G. & Talbot, J. M. Dimensions of biodiversity in the Earth mycobiome. Nat. Rev. Microbiol. 14, 434–447 (2016). 7.Tedersoo, L. et al. The Global Soil Mycobiome consortium dataset for boosting fungal diversity research. Fungal Divers. 111, 573–588 (2021). 8. Abrego, N., Furneaux, B., Hardwick, B. et al. Airborne DNA reveals predictable spatial and seasonal dynamics of fungi. Nature 631, 835–842 (2024). 9. Lynggaard, C., Bertelsen, M. F., & Jensen, C. V., et al. (2022). Airborne environmental DNA for terrestrial vertebrate community monitoring. Current Biology, 32(3), 701-707.e5. 10. Lynggaard, C., Fr?slev, T. G., & Johnson, M. S., et al. (2024). Airborne environmental DNA captures terrestrial vertebrate diversity in nature. Molecular Ecology Resources, 24, e13840. 11. Newton, J. P., Nevill, P., & Bateman, P. W., et al. (2024). Spider webs capture environmental DNA from terrestrial vertebrates. iScience, 27(2).