
2024-07-04

胰腺導管腺癌(PDAC)是致死率最高的實體惡性腫瘤之一,預計將在2030年前成為第二大腫瘤致死原因。對于可進行手術切除的胰腺癌患者,術前是否先進行化療(即新輔助化療),是擺在醫生面前的兩難抉擇。若不開展新輔助化療直接手術,患者很大比例術后會出現胰腺癌的復發、轉移。若術前化療,對于部分可以直接手術的患者對化療不敏感,腫瘤越長越大,反而耽誤了手術的最佳時機。醫生該怎么選?這一決策不僅考驗著醫生的專業判斷力,也凸顯了個性化醫療策略在胰腺癌治療中的重要性。 針對以上困境,上海交通大學醫學院附屬瑞金醫院聯合復旦大學附屬腫瘤醫院研究團隊展開了前瞻性研究,2024年1月29日在Nature Medicine(IF 58.7)上發表了題為 “Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma”的研究論文,直面胰腺導管腺癌(PDAC)治療決策難題。該研究納入了1171例接受根治性切除術的胰腺癌患者,并隨機挑選了其中191例患者的組織樣本進行DIA蛋白質組學分析,揭示了PDAC的功能蛋白模塊并構建了預后模型(亮點①)。同時,通過數據融合分析,發現NDUFB8和CEMIP2作為生物標志物可以精準預測PDAC患者對輔助化療的敏感性(亮點②),經PRM蛋白質組學和IHC驗證,標志物的預測價值及預后模型的有效性得以確證,為化療方案的個性化開辟新徑,標志著PDAC精準醫療領域的重大進步。
隊列設計 發現隊列:RJ-cohort1(n=191)從RJ-cohort中隨機挑選191名患者; 內部驗證隊列:RJ-cohort2(n=50)和RJ-cohort3(n=386); 外部驗證隊列:上海SH-cohort(n=466)和法國FR-cohort(n=230);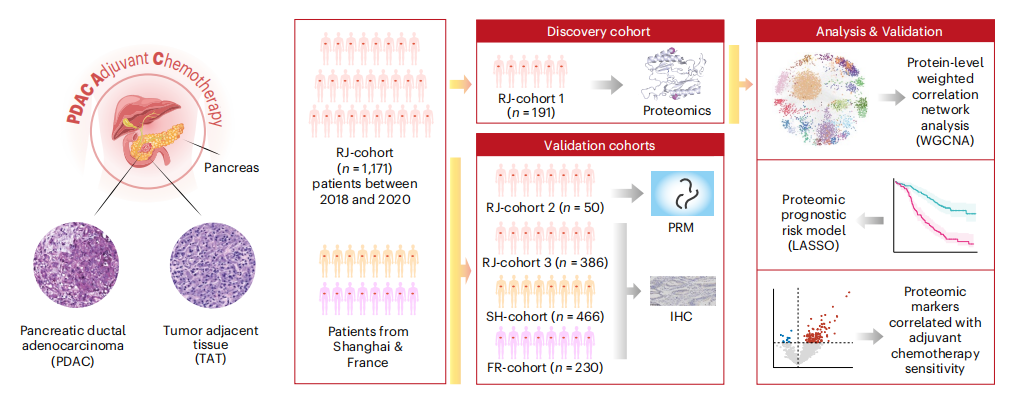
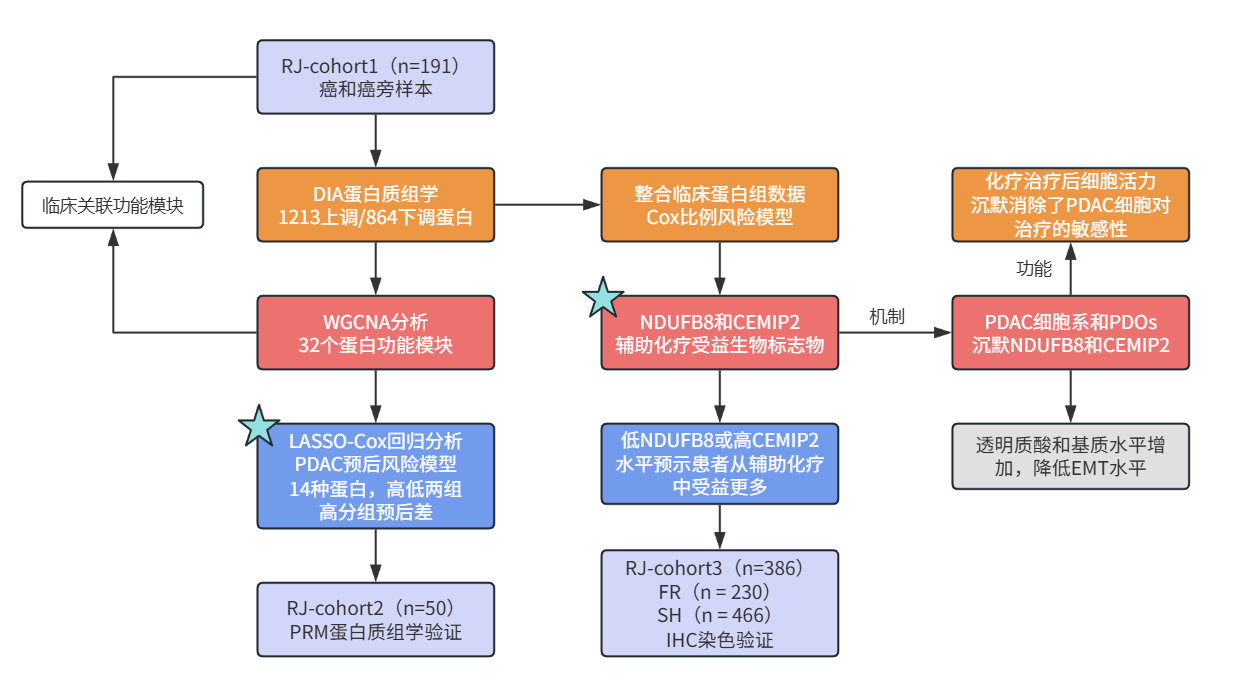
研究思路
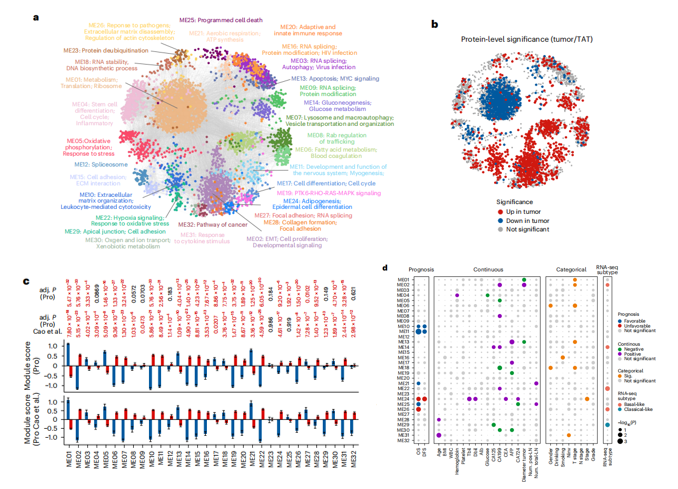
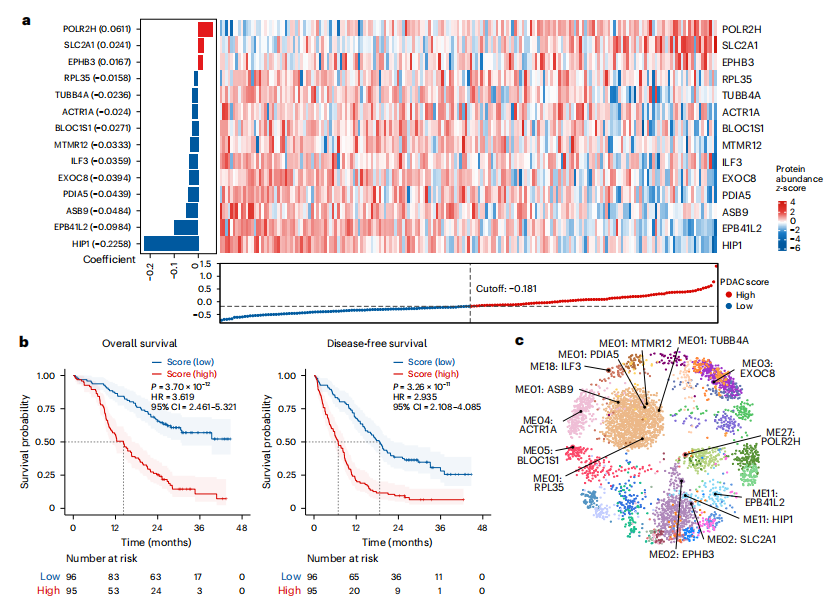
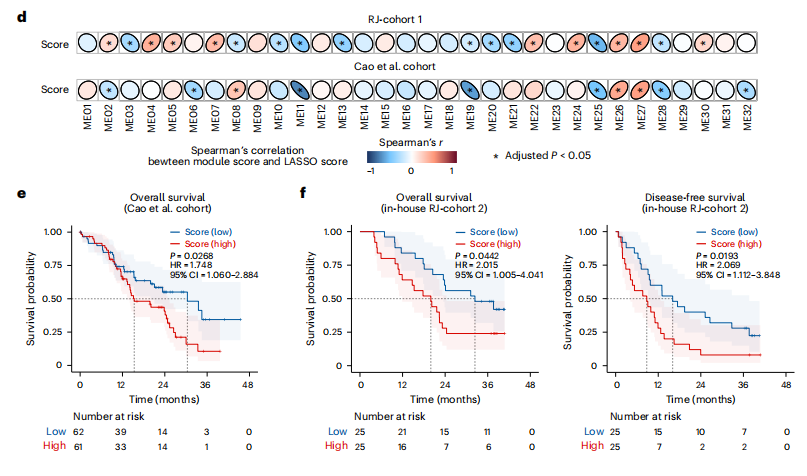
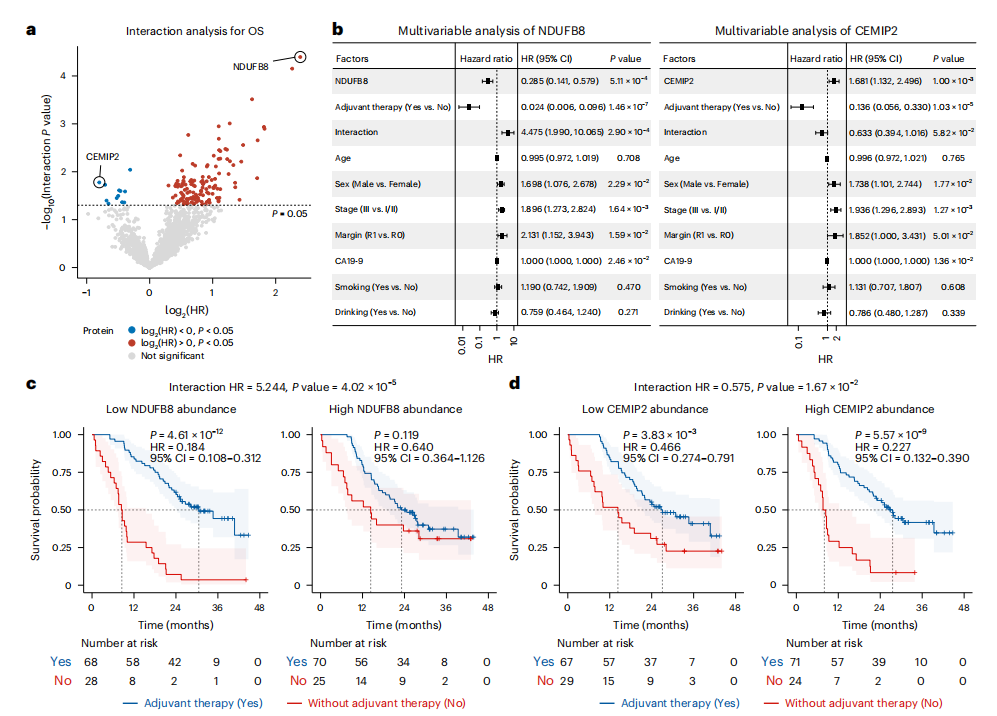
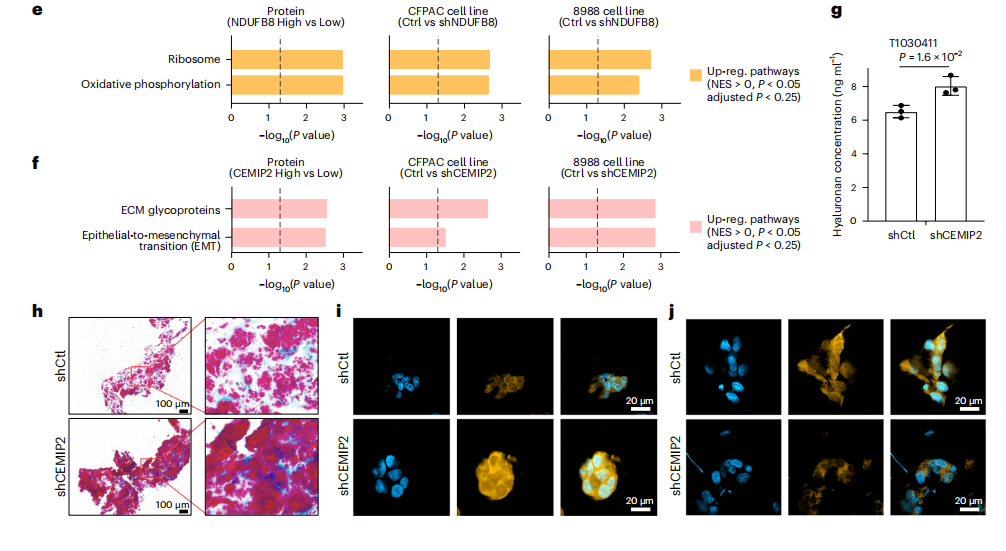
研究結果 一、PDAC蛋白質組學 研究團隊為了找到胰腺導管腺癌(PDAC)患者的最佳治療分層策略,對2018年到2020年期間1171名接受胰腺切除術的中國患者進行了前瞻性觀察研究,收集了患者的詳細人口統計學和臨床病理信息。研究發現,接受含吉西他濱的輔助治療的患者相比未接受輔助治療的患者有更長的總生存期(OS)。為了探究OS差異的分子機制,研究者對191例未經治療的腫瘤樣本和90個配對的腫瘤鄰近組織進行了蛋白質組學分析,發現腫瘤中有1213個蛋白質顯著上調,864個蛋白質下調。腫瘤中的信號通路、補體和凝血級聯活躍,而代謝途徑、氧化磷酸化和核糖體則顯著下調。這些發現有助于揭示PDAC患者生存期差異的分子機制。 PDAC蛋白質組學分析圖 二、WGCNA臨床關聯分析 對腫瘤蛋白質組學數據進行了加權相關網絡分析(WGCNA)分析,共確定了32個功能模塊。通過將差異蛋白質的豐度疊加到WGCNA網絡中,觀察到在腫瘤中顯著上調的16個模塊,而在腫瘤中下調的九個模塊,其模塊得分在他人研究中得到驗證。隨后通過關聯分析探索了這些模塊的臨床相關性,下調的模塊(ME01/13)與腫瘤大小呈負相關,包括核糖體功能、RNA剪接、代謝和氧化磷酸化等細胞必備的功能。在腫瘤中上調的模塊中,ME02、ME08、ME14和ME22與血清中的糖類抗原(CA19-9)水平呈正相關,CA19-9是PDAC患者轉移和復發的獨立風險因素。ME02包含參與上皮細胞-間充質轉化(EMT)和ECM重構的蛋白,ME14富集了糖代謝,ME22則富集了糖酵解和缺氧。這些發現支持了功能蛋白模塊的臨床意義,缺氧和ECM組織可能是腫瘤細胞轉移擴散的潛在原因。此外,部分腫瘤上調模塊與總體生存期(OS)密切相關,其中ME24和ME26與較差的OS相關,而ME10和ME11與較好的OS和無疾病生存期(DFS)相關。 功能蛋白模塊的臨床相關性圖 三、PDAC預后風險模型 基于從上述32個功能模塊中鑒定出的3906個蛋白質,作者通過LASSO-Cox回歸分析建立了PDAC的預后風險模型。該模型包含14個蛋白質,根據患者的LASSO評分將他們分為“高評分”和“低評分”兩組。高評分患者的預后較差,LASSO評分在總生存期(OS)和無病生存期(DFS)上顯示出獨立的預測能力,基因集富集分析(GSEA)顯示,高分組患者的細胞外基質(ECM)受體相互作用通路上調,而趨化因子相關通路下調。為了驗證這一模型的性能,使用了CPTAC19報告的Cao等人隊列驗證了模型中14種蛋白質的預后能力,還納入了RJ-cohort 2(n=50),使用并行反應監測(PRM)方法對每位患者的14個蛋白質進行定量,這50例患者根據他們的LASSO評分(中位數)成功地分為兩組,生存分析進一步證實了該模型在預測OS和DFS方面的預后預測能力。 PDAC預后風險模型 四、PDAC蛋白質組學生物標志物 研究團隊為了識別與PDAC輔助治療反應相關的蛋白質生物標志物,整合了臨床和蛋白質組數據集,使用Cox比例風險模型分析了化療與生物標志物的交互作用,確定了兩個最重要的生物標志物:NDUFB8和CEMIP2與化療顯著相關。NDUFB8是一種與氧化能量代謝至關重要的線粒體呼吸鏈復合體I蛋白,在PDAC中表達下調;而CEMIP2是一種編碼細胞表面透明質酸酶的蛋白,負責將高分子量的透明質酸分解成低分子量的透明質酸,在腫瘤中表達上調。研究發現,低NDUFB8或高CEMIP2水平預示患者從輔助化療中受益更多。輔助化療可以顯著延長低NDUFB8患者的總體生存時間,而高NDUFB8患者從輔助化療中的獲益較小。CEMIP2則與之相反,輔助化療可顯著延長高CEMIP2患者的總體生存時間,不過不論CEMIP2水平高低,患者都能從輔助化療中的獲益。 為了研究NDUFB8和CEMIP2對輔助化療的相互作用機制,研究人員進行了進一步實驗,包括在PDAC細胞系和PDOs中沉默這兩種生物標志物。實驗結果表明,沉默NDUFB8或CEMIP2后,改變的通路與兩個患者亞組的差異豐富蛋白富集的通路一致。CEMIP2沉默導致PDOs中透明質酸和基質水平增加,并且降低了EMT水平。 兩種蛋白質組學生物標志物鑒定 五、生物標志物的外部和內部驗證 研究者使用IHC染色評估了外部PDAC隊列法國(n = 230)和上海(n = 466)以及內部PDAC隊列RJ-cohort 3(n=386)中NDUFB8和CEMIP2的水平。結果顯示,與癌旁(TATs)組織相比,腫瘤中NDUFB8的表達較低,而CEMIP2的表達較高。具有不同化療敏感性的PDAC患者中,這兩種生物標志物的表達水平存在差異,與高表達患者相比,NDUFB8低表達的患者對輔助化療的反應更好,而在CEMIP2低表達的患者中,輔助化療的影響沒有高表達的易感性。 最后,通過功能實驗評估了NDUFB8和CEMIP2對PDAC細胞系化療敏感性的影響。沉默NDUFB8降低了兩種PDAC細胞系(CFPAC和8988)和一種PDO在吉西他濱加紫杉醇、單藥5-FU和基于氟尿嘧啶的化療治療后的細胞活力。相反,沉默CEMIP2消除了PDAC細胞對這些治療的敏感性。 IHC染色對生物標志物驗證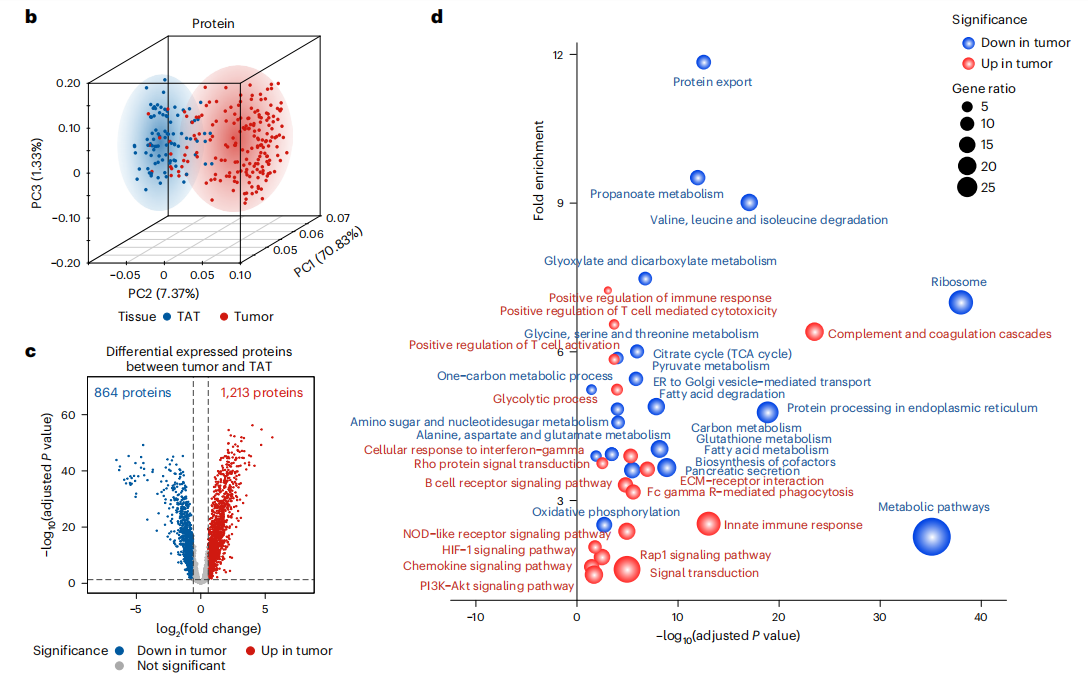
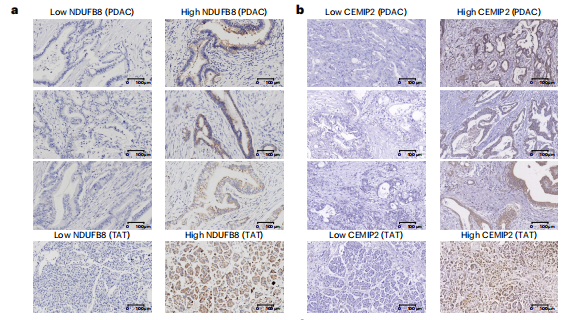
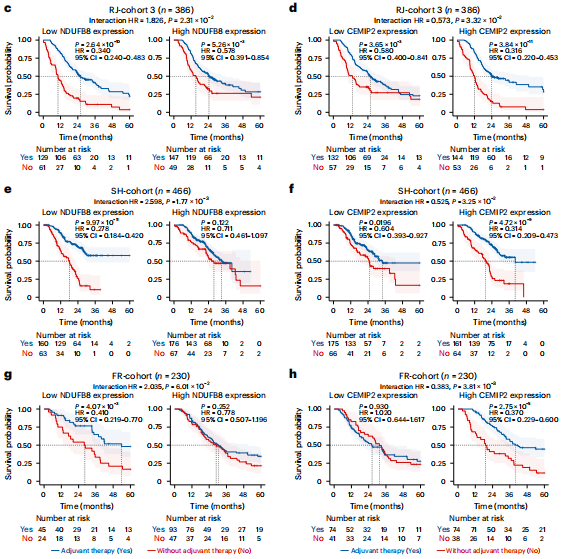
總 結 這項前瞻性觀察研究揭示了臨床相關的功能蛋白模塊,建立了PDAC患者的預后風險模型,并發現了兩種預測PDAC輔助化療生物標志物(NDUFB8和CEMIP2),通過使用外部和獨立的內部隊列進行了嚴格的交叉驗證,低NDUFB8或高CEMIP2水平表明,患者可從輔助化療中受益更多。
參考文獻:Jiang L, Qin J, Dai Y, et al. Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma. Nat Med. 2024;30(3):749-761. doi:10.1038/s41591-023-02790-x