
2024-06-13

過去20多年的研究表明,哺乳動物體內具有數以萬億計的微生物群,遍布各個部位,包括皮膚、唾液、口腔粘膜等部位,其中大多數存在于胃腸道,并與機體代謝健康息息相關,因此,宿主與其微生物群構成了一個“超級生物體”。
近些年,腸道微生物衍生的代謝物及功能機制逐漸被揭示,相關代謝產物作為機體代謝反應的信號分子和底物,影響著宿主生理、病理等過程。盡管如此,仍有大量腸道微生物衍生的代謝物及其與腸道菌群相互作用仍未被識別。目前已經確定的腸道微生物衍生代謝物種類繁多,根據來源和合成的不同,這些代謝物大致可分為三類:(1)腸道細菌從膳食成分中產生的代謝物;(2)宿主產生并經腸道細菌修飾的代謝物;(3)腸道細菌可重新合成的代謝物[1]。
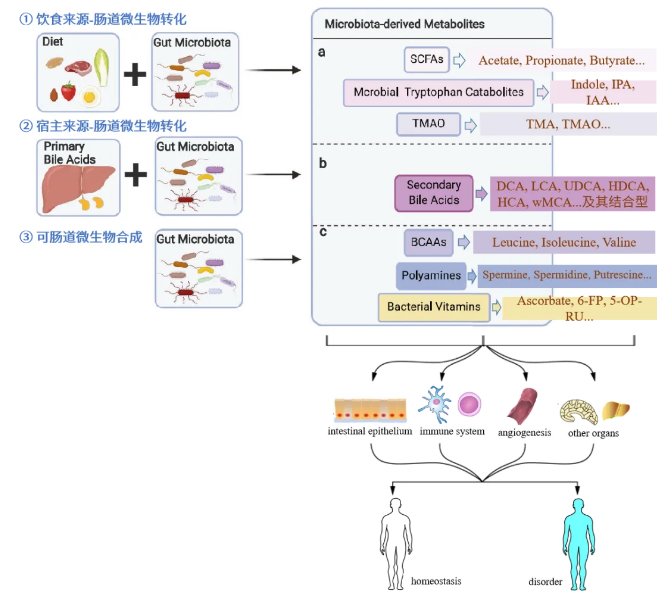
圖1. 腸道菌群相關代謝物的三個來源及其作用
省流版
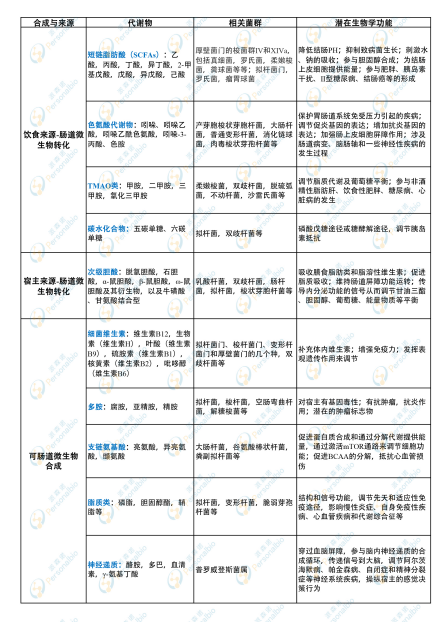
當然,這些腸道菌群相關代謝物類群并非單一來源,既可由外源攝入,也可宿主自身合成,進而通過腸道微生物轉化,同時還可由腸道微生物重新合成。因此,該分類僅做參考,具體代謝物仍需根據具體研究進行歸類。
一、飲食來源腸道微生物轉化
1. 短鏈脂肪酸
膳食營養分子被遠端腸道細菌代謝產生多種代謝物。短鏈脂肪酸(SCFAs)是最常被研究的一類小分子代謝物,它們由腸道微生物發酵膳食纖維產生。乙酸、丙酸和丁酸占總SCFA池95%以上,在小鼠和人類腸道中摩爾比約為60:20:20。此外,支鏈脂肪酸(BCFAs)異丁酸、2-甲基丁酸、異戊酸以及丙酸中間體乳酸和琥珀酸也會產生,雖然豐度很低,也能發揮生物學效應。SCFA不僅是宿主能量轉換的簡單底物以及結腸細胞代謝的營養物質,還可通過多種方式影響能量代謝和體內脂肪。
SCFAs(如乙酸、丙酸和丁酸)可通過表面表達的游離脂肪酸受體或G蛋白偶聯受體(GPCR)GPR41、GPR43和GPR109A發出信號。GPR41廣泛存在于組織中,而GPR43主要表達于淋巴組織和各種免疫細胞中。這些GPCR在組織中的差異表達及其對單個SCFAs的可變親和力是SCFAs不同功能的基礎[2]。
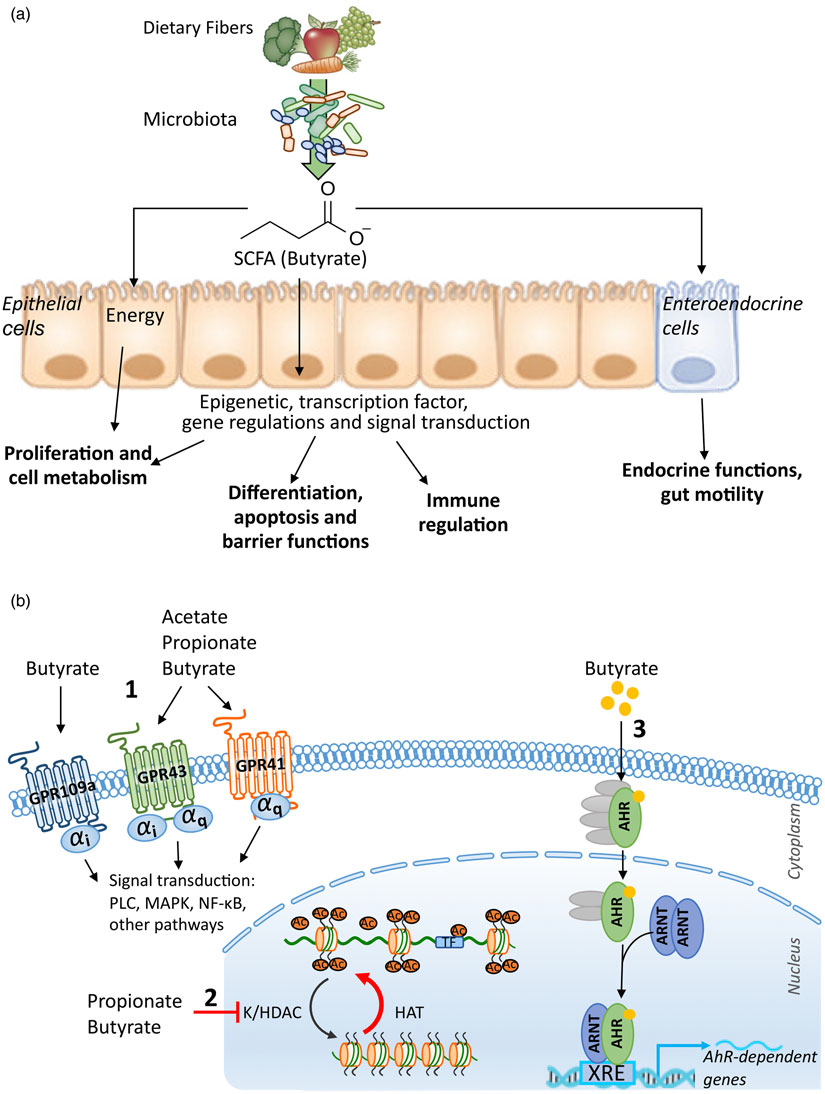
圖2. SCFA對宿主的功能影響與作用機制: (1)G蛋白偶聯受體(GPCR)依賴的信號傳導; (2)組蛋白和轉錄因子被SCFA乙酰化; (3)丁酸鹽作為轉錄因子配體的作用
2. 色氨酸代謝物
色氨酸是一種必需的芳香氨基酸,主要來源于膳食蛋白質。結腸中多種細菌可直接將色氨酸降解為多種代謝物,包括吲哚、吲哚乙醇(IE)、吲哚丙酸(IPA)、吲哚乳酸(ILA)、吲哚乙酸(IAA)、吲哚醛(IAld)、吲哚丙烯酸(IA)、甲基吲哚和色胺等。微生物色氨酸代謝產物的類型和水平主要受腸道菌群的影響,腸道菌群具有不同的色氨酸代謝催化酶。例如,產孢梭狀芽孢桿菌和肉毒球菌可以通過色氨酸脫羧產生色胺,梭狀芽孢桿菌和胃鏈球菌可將色氨酸轉化為IPA。這些色氨酸代謝產物通過血液調節腸道局部免疫反應并系統性影響宿主生理,激活孕烷X受體(PXR)和/或芳烴受體(AhR)[1]。
微生物色氨酸代謝的三大途徑:犬尿氨酸途徑的限速酶是吲哚胺2,3-雙加氧酶1(IDO1;免疫和腸道上皮細胞)或色氨酸2,3-雙加氧酶(TDO;肝細胞);腸道菌群可促進IDO1的表達,IDO1的活性也能調節微生物群落的組成。5-羥色胺途徑的限速酶為色氨酸羥化酶(TPH),TPH1在腸黏膜內腸嗜鉻細胞中表達,TPH2在中樞神經系統和腸神經系統神經元中表達。腸道微生物色氨酸酶將色氨酸代謝為吲哚,進入宿主門循環,在肝臟中轉化為硫酸吲哚酚,再由腎臟排出,高水平硫酸吲哚酚具有腎毒性,其中許多化合物是AhR配體[3]。
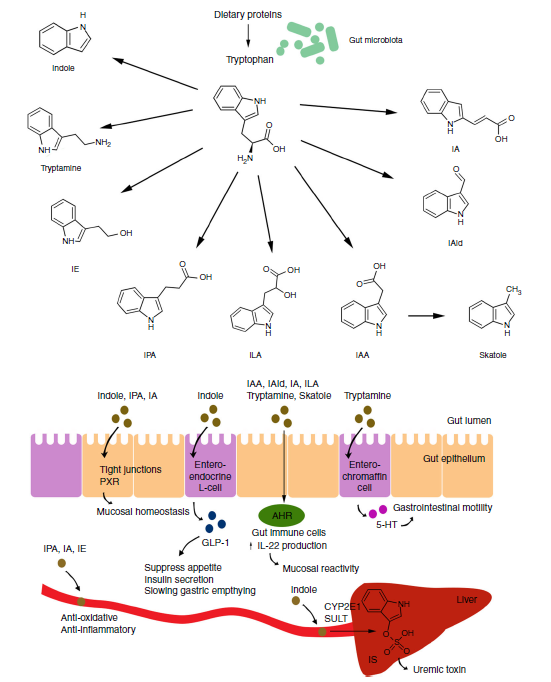
圖3. 微生物色氨酸代謝產物對宿主生理的作用機制
3. TMAO類
膽堿是人類必需的營養物質,既來源于飲食,也可內源合成,厭氧微生物通過代謝它產生三甲胺(TMA)和乙醛,TMA被宿主腸道吸收后在肝臟中通過黃素單加氧酶(FMO3)代謝成氧化三甲胺(TMAO)。機制上,TMAO可通過誘導多個巨噬細胞受體和血栓形成的特征促進動脈粥樣硬化。TMAO的前體三甲基賴氨酸(TML)也被確定為主要不良心臟事件的預測因子[3]。此外,TMAO被證實在腫瘤免疫中也發揮重要作用[4]。
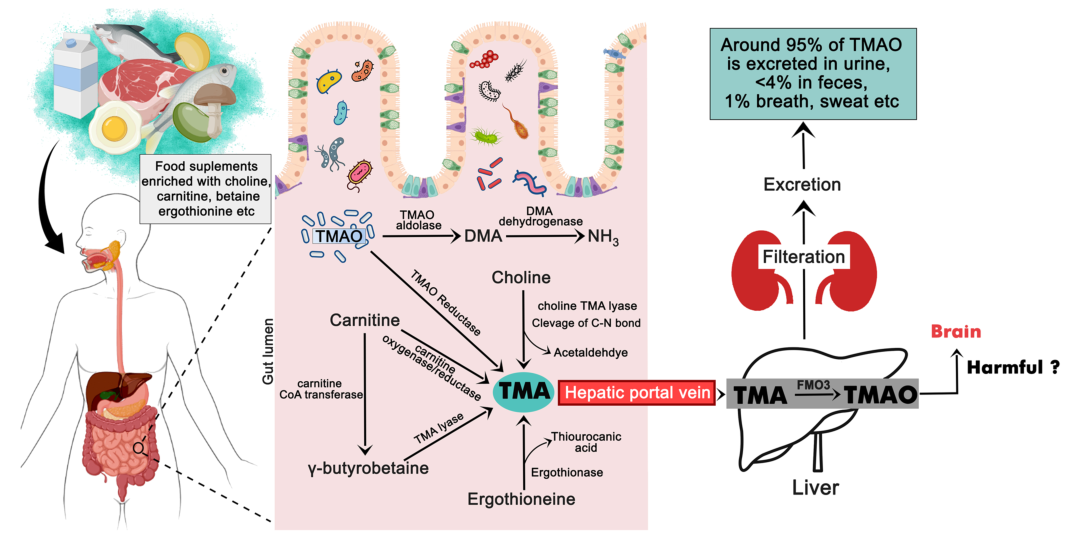
圖4. TMAO的代謝與合成
4. 碳水化合物
食物或粘蛋白的復雜碳水化合物被腸道微生物多糖酶和糖苷酶水解為五碳或六碳單糖,然后通過經典的磷酸戊糖途徑或糖酵解途徑進一步分解代謝為丙酮酸;丙酮酸(或其前體磷酸丙酮酸)通過多種代謝途徑,最終產生SCFAs。研究發現,腸道菌群中的擬桿菌屬,對碳水化物,尤其是單糖,如葡萄糖,果糖,半乳糖,甘露糖,木糖以及阿拉伯糖的代謝,可改善人體胰島素抵抗[5]。
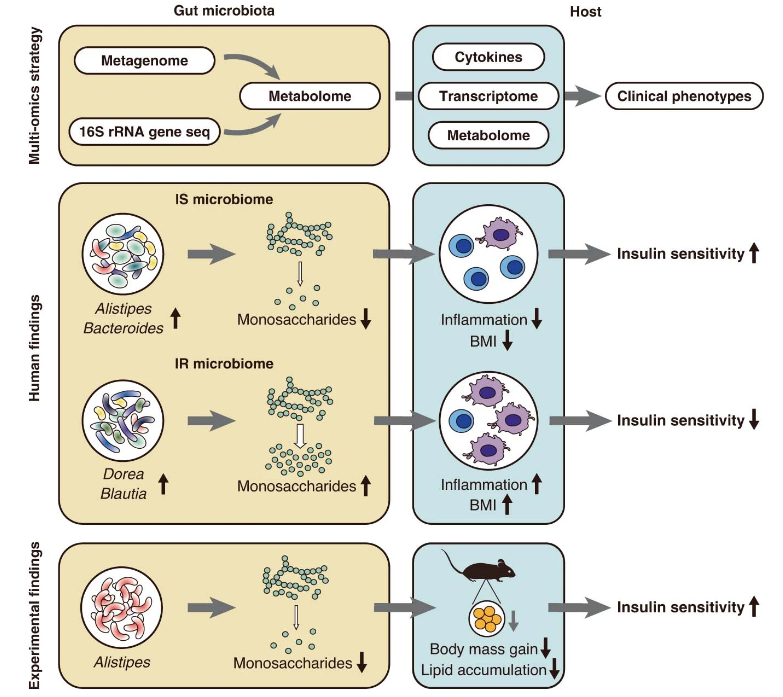
圖5. 腸道菌群通過碳水化合物代謝改善胰島素抵抗
二、宿主來源-腸道微生物轉化
1. 次級膽汁酸
肝臟中膽汁酸(BAs)的合成有兩條途徑,需要至少17種不同的酶,其中經典途徑的限速酶是CYP7A1,并依賴于CYP8B1的活性,產生CDCA或CA,而替代途徑則受CYP27A1調節,主要產生CDCA,CYP7A1和CYP27A1的表達受腸道菌群調控。在遠端小腸和結腸中,BAs受到腸道菌群膽鹽水解酶(BSH)的解偶聯,進而經過微生物轉化,包括脫羥基化、差向異構和氧化等產生一系列次級BAs。
BAs在宿主體內發揮功能主要通過兩種受體:法尼醇受體FXR和G蛋白偶聯膽汁酸受體TGR5。TGR5是一種廣泛表達的跨膜受體,通過促進棕色脂肪組織中的細胞內甲狀腺激素活性,增加棕色脂肪組織和肌肉的能量消耗,并誘導腸L細胞釋放胰島素分泌GLP-1來調節能量平衡。FXR是一種胞漿配體激活的轉錄因子,其作用非常復雜,取決于組織類型和環境因素,既可作為BAs合成和轉運的調節因子,還在調節炎癥和免疫以及肝再生中起著重要作用,并在肝細胞和胃腸道中誘導保護性細胞反應[3]。
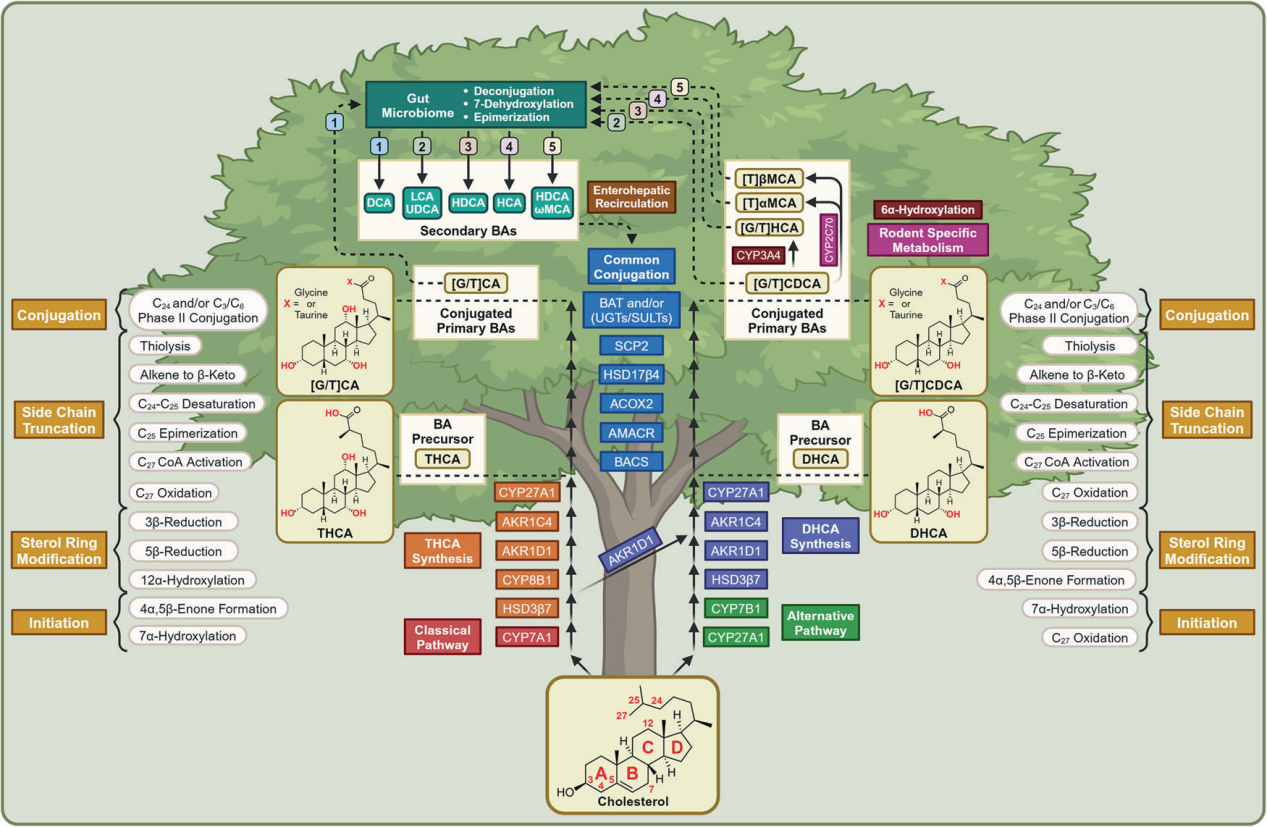
圖6. 膽汁酸的合成與微生物代謝
三、可由腸道微生物合成
1. 支鏈氨基酸
支鏈氨基酸(BCAAs),即亮氨酸、異亮氨酸和纈氨酸,其濃度升高是胰島素抵抗和T2D風險增加的生物標志物。在不健康飲食條件下,腸道菌群可能導致血漿BCAA濃度增加和胰島素抵抗。在血糖正常、有胰島素抵抗的人群中,Prevotella copri和Bacteroides vulgatus豐度增加,導致BCAA合成代謝能力增加;同時Butyrivibrio crossotus和Eubacterium siraeum介導的BCAA攝取和分解代謝能力降低。在心力衰竭中,BCAA分解代謝受到損害,累積的BCAA會誘導氧化應激并破壞線粒體功能[6]。近期一項研究表明,腸道菌Parabacteroide merdae通過促進BCAA分解代謝可抵抗心血管損傷[7]。
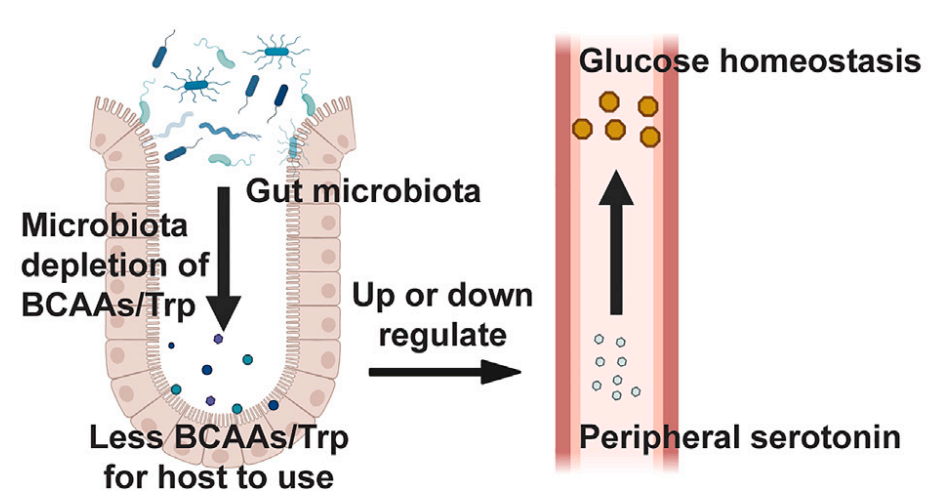
圖7. 腸道菌群-BCAAs調節宿主葡萄糖穩態
2. 多胺類
多胺普遍存在于動各種植物組織中,包括精胺、亞精胺、腐胺等,參與各種生物過程,如增殖、分化和凋亡,它在血漿中的周轉速度快,能夠快速到達靶組織。動物體內的多胺有3種來源:機體自身合成、腸道微生物合成以及外源性攝入,其吸收主要發生在十二指腸和空腸前段。腸道微生物主要通過催化酶的轉氨作用將攝取的氨基酸(尤其是精氨酸)分解產生多胺,廣泛參與生物體內的生理和病理過程[8]。
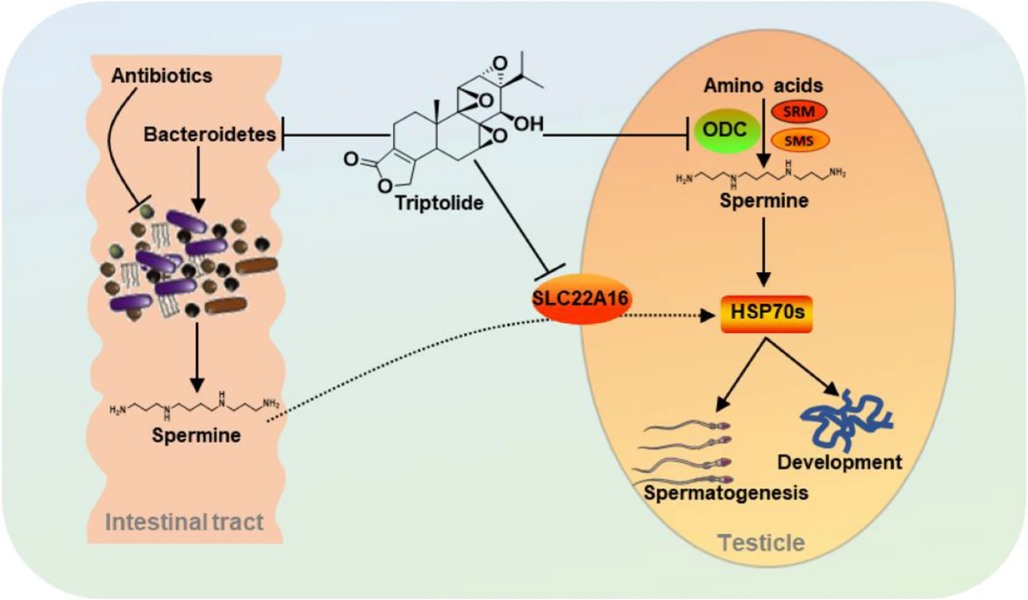
圖8. 腸道菌群多胺代謝參與調節雷公藤甲素對睪丸功能的影響
3. 細菌維生素
B族維生素需從飲食和腸道微生物合成獲得,對于葉酸(維生素B9),結腸微生物所產生的實際超過了飲食攝入。研究報道許多人類常見的腸道細菌具有合成B族維生素能力,腸道菌群代謝B族維生素也具有年齡依賴的差異。嬰兒腸道菌群具有豐富的葉酸從頭合成基因,而成人的菌群含有豐富的葉酸及其還原形式四氫葉酸代謝相關的基因。因此,腸道菌群是必需維生素的重要來源,并可能為治療維生素缺乏癥提供新的策略,特別是與飲食無關的缺乏癥。[3]
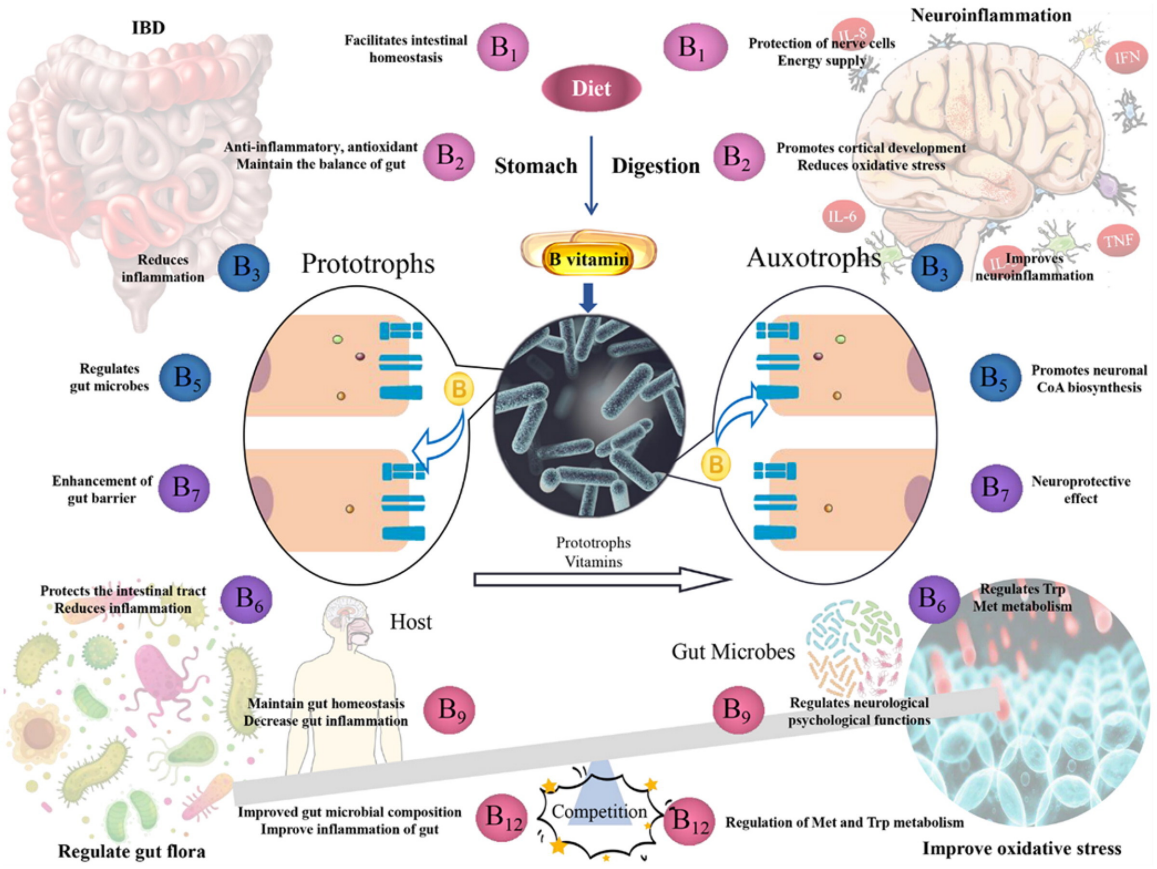
圖9. B族維生素的合成代謝及潛在作用機制
4. 神經遞質
腸道菌群既可以產生神經遞質前體,也可以通過飲食代謝催化神經遞質的合成。細菌和腸內分泌細胞合成的神經遞質可以進入血液循環,運送到身體的其他部位;一些神經遞質前體可以穿過血腦屏障,參與腦內神經遞質的合成循環。此外,位于腸上皮的神經足細胞合成并釋放谷氨酸等神經遞質,通過迷走神經快速將感覺信號傳遞到大腦。腸道微生物群調節的神經遞質/前體合成的變化可能導致腦功能的改變,并影響阿爾茨海默病、帕金森病、自閉癥和精神分裂癥等神經系統疾病。近期一項研究發現,腸道共生細菌Providencia產生的神經遞質酪胺能夠繞過宿主的酪胺生物合成途經來操縱宿主的感覺決策行為[9]。
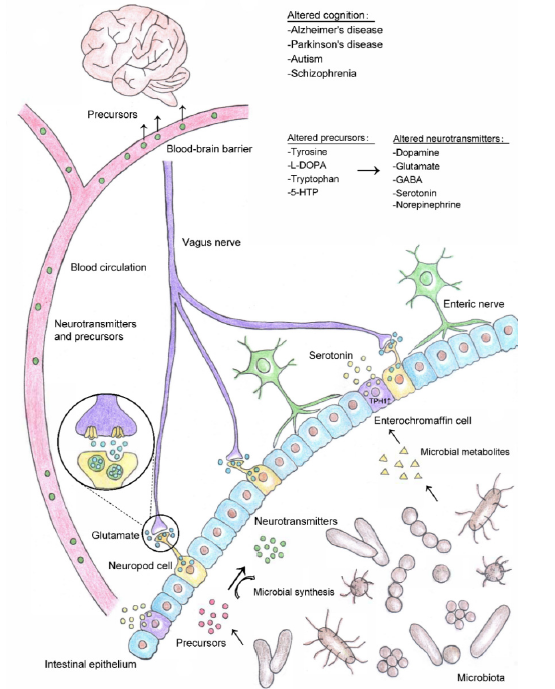
圖10. 腸道微生物介導的神經遞質合成及其對認知的影響
5. 脂類
由腸道微生物生物轉化和生物合成的脂類具有重要的結構和信號功能,可以被宿主直接感知,調節先天和適應性免疫途徑,調節代謝途徑,從而影響慢性炎癥、自身免疫性疾病、心血管疾病和代謝綜合征的進展。此外,微生物誘導的宿主細胞膜脂質組成的變化會影響信號通路,由此產生的下游產物會影響宿主的局部組織和全身免疫和代謝[10]。
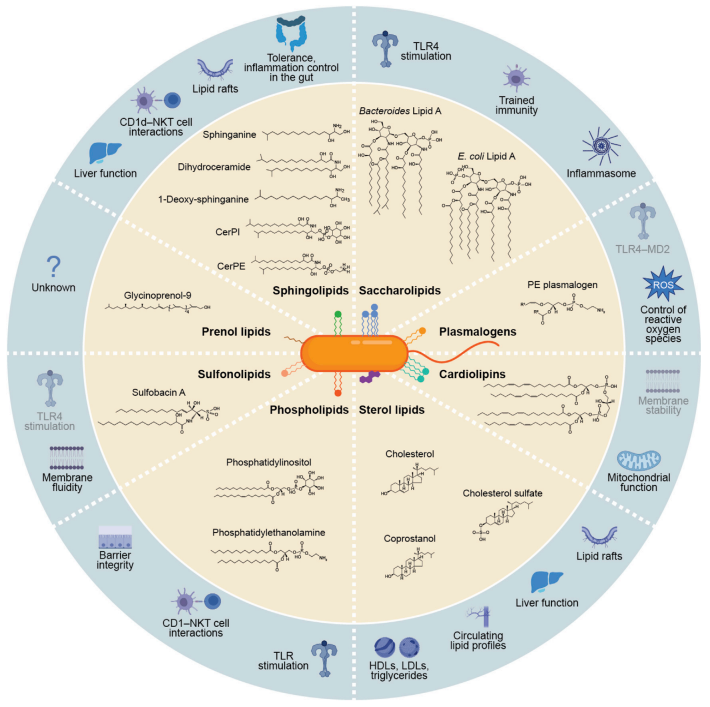
圖11. 腸道微生物組生物合成的膜脂質及其信號功能
除上述研究較多的腸道菌群衍生代謝物外,還有苯多酚、苯甲酰等苯類衍生物,琥珀酸、α-酮戊二酸、乳酸等有機酸,咪唑丙酸等代謝物,通過與腸道菌群相互作用調控宿主穩態。
參考文獻
1.Yang W, Cong Y. Gut microbiota-derived metabolites in the regulation of host immune responses and immune-related inflammatory diseases. Cell Mol Immunol. 2021 Apr;18(4):866-877.
2.Mann ER, Lam YK, Uhlig HH. Short-chain fatty acids: linking diet, the microbiome and immunity. Nat Rev Immunol. 2024 Apr 2.
3.Krautkramer KA, Fan J, B?ckhed F. Gut microbial metabolites as multi-kingdom intermediates. Nat Rev Microbiol. 2021 Feb;19(2):77-94.
4.Wang H, Rong X, Zhao G, et al. The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer. Cell Metab. 2022 Apr 5;34(4):581-594.
5.Takeuchi T, Kubota T, Nakanishi Y, et al. Gut microbial carbohydrate metabolism contributes to insulin resistance. Nature. 2023 Sep;621(7978):389-395.
6.Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021 Jan;19(1):55-71.
7.Qiao S, Liu C, Sun L, et al. Gut Parabacteroides merdae protects against cardiovascular damage by enhancing branched-chain amino acid catabolism. Nat Metab. 2022 Oct;4(10):1271-1286.
8.Zhao Q, Huang JF, Cheng Y, et al. Polyamine metabolism links gut microbiota and testicular dysfunction. Microbiome. 2021 Nov 11;9(1):224.
9.O'Donnell MP, Fox BW, Chao PH, et al. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 2020 Jul;583(7816):415-420.
10.Brown EM, Clardy J, Xavier RJ. Gut microbiome lipid metabolism and its impact on host physiology. Cell Host Microbe. 2023 Feb 8;31(2):173-186.